高一年级化学学科第一学期期末考试试卷
命题人:丁俊宽 曹松 卷面总分:100分 考试时间:90分钟
可能用到的相对原子质量 H:1 C:12 N:14 O:16 Na:23 Al:27
S:32 Cl :35.5 Ca:40 Fe:56 Cu:64
第I卷(选择题 共35分)
一、选择题(共10小题,每题2分,每小题只有一个正确答案,共计20分。)
1、科学家最近发现2种粒子:第1种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是: ( )
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式为O4
2、下列实验操作中,正确的是 ( )
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
3、下列关于铷的叙述中,不正确的是 ( )
A、原子半径比钾的大 B、碳酸铷加热易分解为氧化铷和二氧化碳
C、氯化铷属于离子化合物 D、铷的盐类大多易溶于水
4、金属钠长期露置于空气中,最后变为 ( )
A、Na2O B、Na2O2 C、NaOH D、Na2CO3
5、两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温、同压下放出气体的体积比为1:2,则两份铝片的质量之比为 ( )
A、1:1 B、2:3 C、3:2 D、1:2
6、由一氧化碳和另一种气体组成的混合气体的含氧质量分数为50%,则另一种气体可能是( )
A、N2O B、CO2 C、NO2 D、NO
7、现有钠、镁、铝质量分别为2.3g、2.4g、2.7g,使其分别与含HCl为18.25%的盐酸溶液10g充分反应后,所得H2的质量关系正确的是 ( )
A、氢气质量相同 B、铝放出氢气最多,钠最少
C、钠放出氢气最多,铝最少 D、钠放出氢气最多,镁铝相同
8、Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合后通入品红和BaCl2的混合
溶液,能观察到的现象是:①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀 ( )
A、①② B、①③ C、②③ D、②④
9、向50mL 18mol/L H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物
质的量 ( )
A、小于0.45mol B、等于0.45mol
C、在0.45 mol和0.90 mol之间 D、大于0.90 mol
10、不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是 ( )
A、分别加热这两种固体物质,并将生成的气体通入澄清石灰水中
B、分别在这两种物质的溶液中,加入CaCl2溶液
C、分别在这两种固体中,加入同浓度的稀盐酸
D、分别在这两种物质的溶液中,加入少量澄清石灰水
二、选择题(共5小题,每题3分,每小题有一到两个正确答案;共计15分,)
11、下列除去杂质的方法正确的是 ( )
A、除去CO2中的少量CO:通入O2,点燃
B、除去Na2CO3稀溶液中的少量NaHCO3:加热
C、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
12、下列反应的离子方程式书写正确的是 ( )
A、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
B、金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2
C、金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D、铁跟稀硫酸反应:Fe+2H+=Fe2++H2
13、某溶液中有NH4+、Mg2+、Fe2+、和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 ( )
A、NH4+ B、Mg2+ C、Fe2+ D、 Al3+
14、往100 mL 1mol/L的AlCl3溶液中滴加1mol/L的NaOH溶液,得到5.85g沉淀,则加入NaOH溶液的体积可能是 ( )
A、200 mL B、225mL C、300 mL D、325 mL
15、将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A、0.05 mol B、1mol C、1.05mol D、0.13mol
第II卷(非选择题 65分)
三、填空题:(计34分)
16 (6分)若实验室用氯水和KSCN溶液检某溶液中有无Fe2+,应在待测试液中先加入 、后加入 。若看到 ,说明含Fe2+。
17(8分)有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2(强碱)溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是 ,肯定含有的离子是
,不能确定是否含有的离子是 ,可通过 来进一步确定该离子。
18(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
19(6分)(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。
(2)某次采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH值变小的主要原因是
。
20(6分)(市一中做)某无色透明溶液,跟金属铝反应生成H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、、OH-、NO3-,哪些可能是构成此溶液的成分?
(1)生成Al3+时,可能存在
(2)当生成AlO2-时,可能存在
20(6分)(大丰中学做)X、Y、Z、W四种元素,都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等。X的原子半径为自然界元素中原子半径最小的。W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍。W原子最外层电子数为其电子层数的3倍。⑴这四种元素的名称分别为:X ,Y ,Z ,W 。⑵由这四种元素可组成某种盐,该盐既能与盐酸反应,又能与氢氧化钠溶液反应。该盐的化学式为
四、实验题:(计13分)
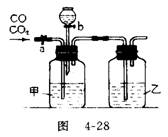 21(7分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
21(7分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
22 (6分) 甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种,将它们两两混合后,观察到如图所示的现象,其中丁与乙产生的是无色气体。
| 甲 | 乙 | 丙 | 丁 | |
| 甲 | — | ↓ | ↓ | — |
| 乙 | ↓ | — | ↓ | ↑ |
| 丙 | ↓ | ↓ | — | ↓ |
| 丁 | — | ↑ | ↓ | — |
请回答下列问题:
⑴写出丁与乙反应的离子方程式
⑵这四种溶液中溶质的化学式分别是:甲 ,乙 ,丙 ,丁 。
五、计算题:(计18分)
23 (8分)现有Na2CO3和NaHCO3的混合固体19.0 g,将其加热至质量不再减少时,冷却,称量,发现固体质量变为15.9 g。求原混合固体中Na2CO3和NaHCO3的质量分别为多少克?
24(10分)将一充满NO2和O2混合气体的试管倒立于水中,若试管的容积为10ml,充分反应后剩余气体为1ml,求原混合气体中NO2和O2的体积各为多少毫升?
高一化学期末考试答案
一、二、选择题(请将选择题的答案填在下表的对应位置)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | A | B | D | D | A | D | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | A | D | C | CD | AC | BD | D |
三、填空题:(计34分)
16、(6分)KSCN(2分);氯水(2分);加入KSCN无现象,加入氯水显红色(2分)
17、(8分)SO42-、CO32-;(2分)Fe3+、Al3+、Cl-;(2分) K+;(2分)焰色反应。(2分)
18、(8分)(1)2Cl2 + 2 Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O (2分)
(2)Ca(ClO)2 (2分)
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO (2分)
(4) (1) (2分)
19、(6分)
(1)(3分)酸 5.6 雨水中溶解了CO2
(2)(3分)酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,发生的反应为:2H2SO3 + O2 = 2H2SO4(方程式没有扣一分)
20、(市一中)(6分)(1)H+、SO42-、Mg2+(3分)(2)OH-、Ba2+、NO3-(3分)
20、(丰中)X 氢 ,Y 碳 ,Z 氮 ,W 氧 。(各1分)NH4HCO3或(NH4)2CO3 (2分)
四、实验题:(计13分)
21、(7分)
(1) (3分)NaOH溶液或碱溶液 浓H2SO4 浓H2SO4
(2)(2分) b a (3)(2分) a b
22、(6分) CO32-+2H+=CO2↑+H2O (2分)
甲 CaCl2 ,乙 Na2CO3 ,丙 AgNO3 ,丁 HCl (各1分)。
五、计算题:(计16分)
23、(6分)mNa2CO3=10.6g mNaHCO3=8.4g
23、(丰中强化班)⑴ SO2、H2 (2分)。
⑵ 总质量:21.6克(3分)⑶36克(3分)
24、(10分)①V(NO2)=7.2ml ;V(O2)=2.8ml
②V(NO2)=8.6ml ;V(O2)=1.4ml
高一化学期末考试答案纸
第II卷(非选择题 65分)
三、填空题:(计34分)
16、(6分)先加入 、后加入 。
若看到 ,说明含Fe2+。
17、(8分)根据上述实验,这包粉末中一定不含有的离子是 ,肯定含有的离子是 ,不能确定是否含有的离子是 ,可通过 来进一步确定该离子。
18、(8分)
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
19、(6分)
(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。
(2)酸雨样品pH值变小的主要原因是
。
20、(市一中做)(6分)
(1)生成Al3+时,可能存在
(2)当生成AlO2-时,可能存在
20(大丰中学做)(6分)
⑴名称分别为:X ,Y ,Z ,W 。
⑵盐的化学式为 。
四、实验题:(计13分)
21、(7分)
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
22、(6分)
⑴写出丁与乙反应的离子方程式 。
⑵这四种溶液中溶质的化学式分别是:甲 ,乙 ,丙 ,丁 。
五、计算题:(计16分)
23、(8分)
24、(10分)