高一年级化学学科第二学期期中考试试卷
命题、审校:富阳中学 项新华
可能用到的相对原子质量:H—1;C—12;O—16;Mg—24;Cu—64;Zn—65
一.选择题(每小题只有一个正确答案,25×2分=50分)
1.随着原子序数的递增,下列说法中正确的
A.原子最外层电子数逐渐增多 B.原子半径逐渐减小
C.元素的最高正价逐渐升高 D.元素的金属性、非金属性呈周期性变化
2.下列有关化学用语表达正确的是
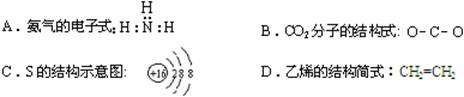 |
3.下列说法错误的是
A.引起臭氧层空洞的原因是氟氯烃的大量使用和发动机废气的排放
B.液晶属于晶体
C.在铜的电解精炼中在阳极下方能得到金、银等贵重金属
D.甲烷在一定的条件下能发生分解
4.周期表中16号元素和5号元素的原子相比较,前者的下列数据是后者的4倍的是
A.质子数 B.最外层电子数 C.电子层数 D.次外层电子数
5.下列说法中错误的是
A.许多化学反应中的能量变化表现为热量的放出和吸收
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.选择燃料只要考虑燃料热值的大小
D.若反应物总能量大于生成物总能量则反应为放热反应
6.下列说法中正确的是
A.镍氢电池和锌锰干电池都是二次电池
B.氢氧燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铜片、锌片、导线和橙子组成的水果电池负极是铜片
7.下列事实与电化学腐蚀无关的是
A.埋在潮湿泥土中的铁管比埋在干燥泥土中的更易被腐蚀
B.为保护海船的螺旋浆和船壳,往往在螺旋浆和船壳上镶入锌块
C.在干燥空气中纯银制品的表面生成一层黑色物质
D.镀银的铁制品,镀层部分受损后,露出的铁表面暴露在潮湿空气中更易腐蚀
8.下列说法不正确的是
A.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
B.光—热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式
C.氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境
D.人类利用的能源都是通过化学反应获得的
9.下列各组顺序的排列不正确的是
A.离子半径:K+<Na+<Mg2+<Al3+
B.热稳定性:HCl>H2S>PH3>SiH4
C.酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4
D.熔点:金刚石>NaCl>Na>CO2
10.下列说法正确的是
A.因为水分子内存在氢键,所以水分子非常稳定
B.相同温度下水的密度比冰小,与水分子间的氢键有关
C.水分子间存在氢键使水分子间作用力增加,导致水的沸点较高
D.化学键是指物质中相邻的原子或离子间的强烈的吸引作用
11. 某元素X的原子核外电子数等于核内中子数,取该元素的单质2.8克与氧气充分应可得6克化合物XO2,该元素在周期表中的位置是
A.第二周期IVA族 B.第三周期IVA族 C.第二周期VA族 D.第三周期VIA族
12.共价键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是
A.SiO2晶体 B.干冰 C.NaCl晶体 D.晶体氩
13.下列过程中,共价键被破坏的是
A.碘升华 B.HI气体受热分解 C.液态水气化 D.金属钠熔化
14.下列晶体或分子中,含有化学键类型有差异的一组是
A.H2O、CO2 B.MgF2、H2O2 C.NaOH、Ba(OH)2 D.NaCl、KCl
15.下列哪些实验事实不能说明有分子间作用力的存在
A.甲烷燃烧放出大量的热 B.液氯汽化要吸收一定的能量
C.降低温度氯气会凝结成液态 D.增加压强CO2会凝结成固态
16.钋(Po)元素位于第ⅥA族元素,其原子序数为84,有关钋及其化合物推测正确的是
A.钋的氢化物很稳定 B.该元素位于第7周期
C.钋是一种非金属元素 D.该元素与硫元素同主族
17.要增大Zn片与1mol/L的H2SO4溶液反应制取氢气的速率,下列措施不可行的是
A.加入6mol/LHNO3溶液 B.滴加硫酸铜溶液
C.使用锌粉 D.加入2mol/L的H2SO4溶液
18.一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A.1个N≡N键断裂的同时,有6个N-H键断裂 B.N2、H2、NH3浓度相等
C.N2、H2、NH3三种物质共存 D.单位时间生成nmolN2的同时分解2nmolNH3
19.下列选项中Q1大于Q2的是
A.等质量的氢气在相同条件下完全燃烧生成液态水和气态水时放出的热量分别为Q1和Q2
B.等质量的固体硫和硫蒸气在相同条件下完全燃烧放出的热量分别为Q1和Q2
C.等质量的碳燃烧生成CO和CO2时放出的热量分别为Q1和Q2
D.1gH2和2gH2燃烧生成液态水时放出的热量分别为Q1和Q2
20.下列有关甲烷的说法中不正确的是
A.甲烷在空气中燃烧的反应是甲烷的氧化反应
B.甲烷与氯气光照制取四氯化碳的反应是取代反应
C.CHCl3与HF反应生成CHFCl2和HCl的反应是复分解反应
D.用甲烷生产炭黑是分解反应
21.一个化学电池的总反应方程式为:Zn+Cu2+==Zn2++Cu,该化学电池的组成可能为
| A | B | C | D | |
| 正极 | Cu | Cu | Zn | Al |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuSO4 |
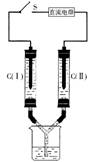
|
的NaCl饱和溶液,C(I)、C(Ⅱ)为多孔石墨
电极。接通S后,C(Ⅱ)附近溶液变红,两玻
璃管中有气体生成。下列说法正确的是
A.C(I)的电极名称是正极
B.C(Ⅱ)的电极反应式是2Cl--2e-=Cl2↑
C.电子从电源的负极沿导线流向C(Ⅱ)
D.电解过程中,C(I)、C(Ⅱ)两极产生的气体质量相等
23. 将4molA气体和2molB气体在2L的容器中混合,并在一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g)。若经过2s测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是:①用物质A表示的平均反应速率为0.3mol/L·S;②用物质B表示的平均反应速率为0.6mol/L·S;③2s时物质A的转化率为70% ④2s时物质B的浓度为0.7mol/L
2C(g)。若经过2s测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是:①用物质A表示的平均反应速率为0.3mol/L·S;②用物质B表示的平均反应速率为0.6mol/L·S;③2s时物质A的转化率为70% ④2s时物质B的浓度为0.7mol/L
A.①③ B.①④ C.②③ D.③④
24.氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平)。
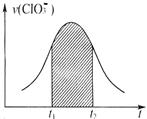 已知该反应的速率随c(H+)的增大而加快,下列为V(ClO3-
)随时间t变化而变化的V-t图。下列说法中不正确的是
已知该反应的速率随c(H+)的增大而加快,下列为V(ClO3-
)随时间t变化而变化的V-t图。下列说法中不正确的是
A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为V(H+)的V-t曲线与图中曲线完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”可以表示t1-t2时间内c(Cl-)增加量
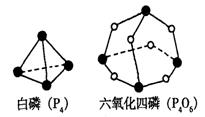 25.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构,如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1,P—O 360kJ·mol—1
25.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构,如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1,P—O 360kJ·mol—1
氧气分子内氧原子间的键能为498kJ·mol—1则
P4+3O2=P4O6的△H为
A.+1638 kJ·mol—1 B.一1638 kJ·mol—1
C.一126 kJ·mol—1 D.十126 kJ·mol—1
二.填空题(本题包括6个小题,共32分)
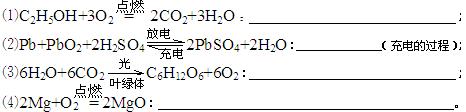 26.(4分)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式
26.(4分)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式
![]() 27.(5分)将下列物质进行分类:①
27.(5分)将下列物质进行分类:①![]() 与
与![]() ;②石墨与富勒烯;③乙烷与辛烷;④硝基丙烷(CH3CH2CH2—NO2)与丙氨酸(
);⑤CH3CH2CH2CH3和(CH3)2CHCH3;⑥天然气的主要成分与沼气的主要成分;⑦一氯甲烷与二氯甲烷;⑧HF与HCl。并对各组物质的性质异同点进行分析,用数字序号回答问题:
;②石墨与富勒烯;③乙烷与辛烷;④硝基丙烷(CH3CH2CH2—NO2)与丙氨酸(
);⑤CH3CH2CH2CH3和(CH3)2CHCH3;⑥天然气的主要成分与沼气的主要成分;⑦一氯甲烷与二氯甲烷;⑧HF与HCl。并对各组物质的性质异同点进行分析,用数字序号回答问题:
⑴互为同素异形体的是 ;⑵互为同分异构体的是 ;
⑶互为同位素是 ;⑷属于同一化合物的是 ;
⑸互为同系物的是 。
28.(7分)现有①BaCl2 ②金刚石 ③ 金属铜 ④KOH ⑤干冰 ⑥固态氮气⑦二氧化硅⑧白磷⑨K2O⑩NH4Br六种物质,按下列要求回答(填序号):
⑴熔化时需要破坏共价键的是________;⑵既含有共价键又含有离子键的是 ;
⑶属于共价分子单质的是 ;⑷属于金属晶体的是_____ _______ ;
⑸化学式只表示粒子数目的最简比,且比值为1:2的是 ;
⑹写出⑤和⑩的电子式,⑤ ,⑩ 。
29. (5分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A的元素符号为: O ;D的原子结构示意图是:Cl的原子结构示意
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) S2- > O2
⑶A、B、C、D形成的化合物B2A2、CD2、D2A中各原子都满足最外层8电子结构的是 NaO SCl Cl (填写具体的化学式 ),写出CD2的电子式: 。
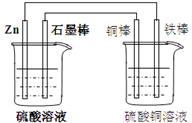
30.(5分)对右图中加以必要的连接并填空:
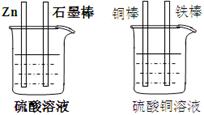 ⑴现有如右图所示两个烧杯,画出必要的连线,使连
⑴现有如右图所示两个烧杯,画出必要的连线,使连
接后的装置能达到在铁棒上镀上一层铜的目的。
⑵分别写出石墨棒和铜棒的电极反应式
石墨棒:
铜棒:
⑶若锌减少了6.5g,则在铁棒上镀上Cu的质量为 。
31.(6分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。下面是某些短周期元素的x值:
| 元素 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
⑴通过分析x值变化规律,确定Mg的x值范围: < x(Mg) < ;
⑵推测x值与原子半径关系是 ;
根据短周期元素的x值变化特点,体现了元素性质的 变化规律。
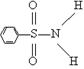 |
⑶某有机化合物结构式为 ,其中S—N中,你认为共用电子对偏向谁?
(写原子名称)。
⑷经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx < 1.7,一般为共价键,试推断:AlCl3中化学键类型是 。
三.实验题(本题包括1个小题,共6分)
32.(6分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
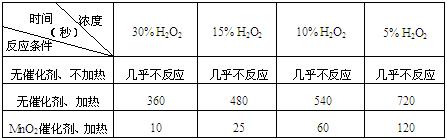
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
⑵将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生的化学反应方程式_______________ _________。
②实验结果说明催化剂作用的大小与________ ________________有关。
⑶若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,写出该反应的热化学方程式: 。
四.计算题(本题包括2个小题,共12分)
33.(6分)在25℃时,将7.2g镁条放入过量的100mL稀盐酸中。反应开始至1min末收集到氢气2.24L(标准状况下),1min末到2min末时镁条减少3.6g,在此之后,又经过2min镁条全部溶解,假设反应前后溶液体积始终为100mL,则:
⑴在反应开始至1min末时间用MgCl2表示的平均反应速率为多少?
⑵在1min末到2min时间用HCl表示的平均反应速率为多少?
⑶比较0~1min,1min~2min,2min~4min,三段时间的反应速率的大小,并解释原因。
34.(6分)取一定量的某气态烃完全燃烧后,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重2.25g,碱石灰增重4.4g。已知该烃在标准状况下的密度是2.59g/L。
⑴求该烃的分子式。
⑵又知1g该气态烃完全燃烧生成CO2气体和液态水时释放出49.6kJ的热量,写出该气态烃燃烧的热化学方程式。
高一年级期中考试化学答卷
一.选择题(每小题只有一个正确答案,25×2分=50分)
| 题目 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | D | B | D | C | C | C | D | A | C | B | B | B |
| 题目 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
| 答案 | B | A | D | A | A | A | C | B | C | B | B | B |
|
二.填空题(本题包括6个小题,共32分)
26.(4分)⑴ 化学能转化为热能 ;⑵ 电能转化为化学能 ;
⑶ 太阳能转化为生物质能 ;⑷ 化学能转化为光能 。
27.(5分)⑴ ② ;⑵ ④⑤ ;⑶ ① ;⑷ ⑥ ;⑸ ③ 。
28.(7分)⑴___②⑦__;⑵ ④⑩ ;⑶ ⑥⑧ ;⑷ ___③__ ;⑸ ⑦⑨ ;
⑹⑤ ![]() ,⑩
,⑩ ![]() 。
。
29. (5分)⑴O O ; C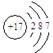 ⑵ S- S2->O2->Na+22 S
⑵ S- S2->O2->Na+22 S
⑶ Na2O2、SCl2、Cl2O ![]() 。
。
 30.(5分)⑴
30.(5分)⑴
⑵石墨棒: 2H++2e-=H2↑
铜棒: Cu-2e-=Cu2+
⑶ 6.4g 。
31.(6分)⑴ 0.93 < x(Mg) < 1.61 ;
⑵ 同周期(同主族)中,x值越大,其原子半径越小 ; 周期性 。
⑶ 氮原子 ⑷ 共价键
三.实验题(本题包括1个小题,共6分)
32.(6分)⑴① 温度 、 催化剂
![]() ② 升高温度化学反应速率增大或加催化剂化学反应速率增大
② 升高温度化学反应速率增大或加催化剂化学反应速率增大
⑵①______2H2O2 = 2H2O+O2↑______。
②_______催化剂的聚集状态或表面积______。
⑶ _2H2O2(l)= 2H2O(l)+O2(g) △H=-196.52kJ·mol 。
四.计算题(本题包括2个小题,共12分)
33.(6分)
⑴1mol·(L-·min)-1 (2分) ⑵3mol·(L·min)-1(2分)
⑶前两段时间里反应速率增加,原因是该反应是放热反应使化学反应速率增大的趋势超过该过程中盐酸浓度减少导致反应速率减少的趋势;后两段时间反应速率减小,原因是盐酸浓度减小导致反应速率减小的趋势超过反应放热导致反应速率增大的趋势。(2分)
34.(6分)
⑴C4H10 (4分)
⑵C4H10(g)+13/2O2(g)= 4CO2(g)+5H2O(l) △H=-2876.8kJ·mol (2分