高一年级化学第一册期中考试试卷
高一化学(强化班)试卷
可能用到的相对原子质量:H-1,O-16,C-12,Ca-40,Cl-35.5,Na-23
卷Ⅰ(选择题,共40分)
一、选择题(每题只有一个正确选项,每小题2分,共20分)
1.下列各组物质中,前者为强电解质,后者为弱电解质的是 ( )
A.硫酸 硫酸镁 B.碳酸 碳酸钠 C.食盐 酒精 D.碳酸氢钠 醋酸
2.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是 ( )
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
3.下列灭火剂能用于扑灭金属钠着火的是 ( )
A.干冰灭火剂 B.黄沙 C.干粉灭火剂 D.泡沫灭火剂
4.已知反应①2BrO3- + Cl2 =Br2 +2ClO3- ②5Cl2 + I2 +6H2O=2HIO3 +10HCl
③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是 ( )
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
5.下列氯化物,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
6.下列离子方程式书写正确的是 ( )
A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O
B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓
C.氢氧化铜和硫酸反应 OH-+H+=H2O
D.铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu
7.在一密闭容器中,盛aLCl2和H2的混合气体,用电火花引燃,恢复原来的状态,发现混合气体仍为aL,用足量的NaOH吸收引燃后的气体,结果气体被完全吸收,由上可知原混合气体中Cl2和H2的体积比一定为 ( )
A.1∶1 B.≥1∶1 C.≤1∶1 D.任意比
8.浓HCl与次氯酸钙能反应:Ca(ClO) 2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓HCl反应制得的氯气中,可能含有杂质气体是:①CO2;②HCl;③H2O(气);
④O2 ( )
A.①②③ B.②③④ C.②③ D.①④
9.甲、乙、丙、丁四个烧杯内分别放入0.1mol的Na、Na2O、Na2O2、NaOH,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁中质量分数大小的顺序为 ( )
A、甲<乙<丙<丁 B、丁<甲<乙=丙
C、甲=丁<乙=丙 D、丁<甲<乙<丙
10.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 ( )
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
二、选择题(每题有1~2个正确选项,每小题2分,共20分)
11.关于氧化剂的叙述正确的是 ( )
A.分子中不一定含有氧元素 B.分子中一定含有氧元素
C.在反应中易失电子的物质 D.在反应中易结合电子的物质
12.有10.2g镁和铝的混和粉末溶于4 mol·L-1的盐酸500mL中。若加入2 mol·L-1的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为( )
A、100mL
B、500mL
C、1000mL
D、1500mL
13.将0.2molMnO2和50ml 12mol/L盐酸混合后加热,反应完全后,向剩下的溶液中加入
足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发)( )
A.等于0.3 mol B.小于0.3 mol
C.大于0.3 mol,小于0.6mol D.等于0.6mol
14.下列除去杂质的方法正确的是 ( )
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
15.溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O==HBr+HIO.下列有关叙述中不正确的是 ( )
A.IBr是双原子分子
B.IBr与水反应时,它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaI和NaBrO
16.粗盐水过滤后仍含有可溶性的CaCl3、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
A.③②①⑤④ B.②③①④⑤ C.③①②⑤④ D.③⑤②①④
17.对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A、Cl2是氧化剂,NaOH是还原剂
B、被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C、Cl2既做氧化剂又做还原剂
D、氧化剂得电子数与还原剂失电子数之比为5∶1
18.已知钡的活动性处于钾和钠之间。下列反应可以实现的是( )
A、钡可以从氯化钾溶液中置换出钾
B、钡可以从冷水中置换出氢而得到氢气
C、钡可以从氯化钠溶液中置换出钠
D、在溶液中钡离子可以氧化金属锌
19.一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来温度。下列叙述中,合理的是 ( )
A、NaOH溶液浓度增大,并放出H2 B、溶液中NaOH的质量分数不变,有H2放出
C、总溶液的质量减小,有H2放出 D、总溶液的质量不变,有H2放出
20.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是 ( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
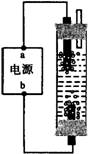 C.a为阳极,b为阴极;HClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
一~二、选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
卷Ⅱ(非选择题,共60分)
三、(21题8分,22题4分,共12分)
21.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
22.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、加热分解 C、结晶法D、分液法E、蒸馏法 F、过滤法
(1) 分离饱和食盐水和沙子的混合物
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3) 分离水和汽油的混合物
(4) 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶
四、(23题10分)
23.据报道,2005年3月29日晚6时许,京沪高速淮安段,一辆由山东开往上海方向的槽罐车与一辆迎面驶来的解放牌大货车相撞后翻倒在地,槽罐车上满载的约32吨液态氯气快速泄漏。泄露出的氯气迅速向周围的村庄蔓延,所到之处草木枯黄、大片作物被毁。中毒死亡者达28人,另有350多人入院治疗。请回答下列问题:
(1)如果你当时在现场,你应该往哪里撤离?(山坡上/低洼处)
(2)如果你在附近学校化学实验室准备撤离时,应该准备什么样的简易“防毒面具”避免吸入较多的氯气?
(3)如果你当时在距离出事地点较近的家中,如何利用家中现成物质来制作简易“防毒面具”?
(4)消防官兵赶到现场处理,他们先把泄露的氯气钢瓶投入一盛有某物质水溶液的水缸中,该物质是
(5)对于弥漫在空气中没有散去的氯气,消防队员喷洒了一种挥发性化学物质水溶液进行处理,该化学物质是
五(24题6分,25题22分)
24.测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
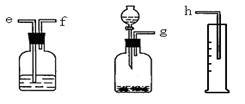
①标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.5L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
25.下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
|
|
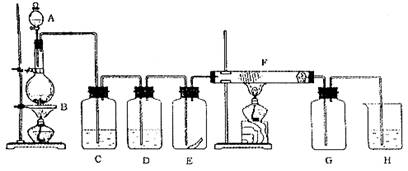
试回答:
(1)A中所放试剂为_______________,B中所放试剂为_____________,二者反应的化学方程式为_______________________ _________,该反应中的氧化剂是 ;
(2)C中试剂是______ ____;D中试剂的作用是_____________ _______;
(3)E中现象是_______________________; F中现象是_______________________,
其反应的化学方程式为___________ ___________;F管中脱脂棉的作用是___________________ ____;
(4)H中试剂为___________;
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是_____________
(填写①或②)
五、(26题4分,27题6分,共10分)
26.取Xg Na-Al合金加入水后,产生0.04mol氢气,此时溶液澄清。当再滴加入 1.00 mol·L-1盐酸到40.0mL时,溶液开始出现浑浊。试计算:
(1)合金中Na与Al的物质的量之比;
(2)求X的值。
27.维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2 C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
答案:
一~二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | B | C | D | B | B | A | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AD | C | C | C | BD | AC | C | B | BC | D |
21、(1)2Cl2+2Ca(ClO)2==Ca(ClO)2+CaCl2+2H2O (2) Ca(ClO)2
(3)Ca(ClO)2+CO2+H2O ==CaCO3↓+2HClO (4) (1)
22、(1)F;(2)C;(3)D;(4)E
23、(1)山坡上
(2)用毛巾沾弱碱性溶液(如:NaHCO3溶液),捂住口和鼻
(3)用毛巾沾肥皂水,捂住口和鼻 (4)NaOH溶液 (5)氨水
24、① g f e h ;收集并测量被压出的水的体积 ② 51.34%
|
25、(1)浓盐酸;MnO2; MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O;MnO2
|
(3)干燥的红色布条不褪色;棕黄色的烟; Cu+Cl2 ==CuCl2;
防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管
(4)NaOH溶液
(5)先②后①
26、(1)5∶1(与盐酸反应的溶液为NaOH和NaAlO2混和液,余NaOH为 0.04mol,对应放H2 0.02 mol又因生成NaAlO2 1 mol放H2所以Na 2mol共为0.05mol。
(2)0.05mol×23g·mol-1+0.01mol×27 g·mol-1=1.42g
27、
(1)因为CH3COOH稀溶液中溶有O2,O2会氧化维生素C,所以要煮沸赶O2。
(2)92.40%