高一年级化学第一学期期中考试
试卷
命题人:蒋宇清 校题人:于容峻 审题人:翟新民
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。考试结束后,将第一卷答题卡和第二卷答题纸一并交监考老师。考试时间90分钟,满分100分。
可能用到的相对原子质量:H 1 O 16 Na 23 K 39 Cl 35.5 Ag 108 Mn 55
第 一 卷(选择题 共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸⑥静止后会出现黑色沉淀。其中正确的是
A.①④⑥ B.②③⑤ C.②③④ D.①③④⑥
2.物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A. ①③⑤ B. ①②⑤ C. ①⑤⑥ D. ①④⑤
3.下列溶液中的氯离子浓度与100mL 0.5 mol•L―1氯化铝溶液中的氯离子浓度相等的是
A.50mL 1.5 mol•L―1的KCl溶液 B.50mL 0.5 mol•L―1的FeCl2溶液
C.100mL 1 mol•L―1的MgCl2溶液 D.450mL 0.5 mol•L―1的NaCl溶液
4.现有四组液体:①水和四氯化碳组成的混合液 ②43%的乙醇溶液 ③单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
5.根据下列反应方程式,判断指定的四种物质的氧化性由强到弱的顺序正确的是
(1)Cl2+2KI=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2 (4)H2S+I2=2HI+S
A.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
6.将一小块钠投入盛有硫酸铜溶液的试管里,不可能观察到的现象是
A.钠熔成小球并在液面上游动 B.有气泡生成
C.溶液底部有红色物质生成 D.溶液变浑浊
7.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是
A.分别加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色呈黄色是小苏打
C.等质量碳酸钠和碳酸氢钠分别与足量的食醋反应,前者产生二氧化碳质量少
D.先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打
|
8.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质(生成的产物)并不改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.木炭(C)和O2
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L水含有6.02×1022个水分子
B.氧气和臭氧的混合物1.6 g中含有6.02×1022个氧原子
C.7.8 g Na2O2与水反应时转移6.02×1022个电子
D.1.12 L氯气中含有6.02×1022个氯原子
10.某无色透明的酸性溶液中能大量共存的一组离子是
A.NH4+ 、CO32-、Al3+、Cl- B.Na+、HCO3-、K+、SO42-
C.MnO4-、K+、SO42-、Na+ D.Mg2+、Na+、SO42-、NO 3-
11.下列离子方程式正确的是
A.铁与稀硫酸反应:2Fe +6H+ =2Fe3+ +3H2↑
B.H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
C.氢氧化镁溶于盐酸:Mg(OH)2 +2H+ =Mg2+ +2H2O
D.钠放于水中:Na+H2O =Na++OH- +H2↑
12.用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
A.氧化铝与酸不反应 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝高 D.铝箔表面温度低,未熔化
13. 24mL浓度为0.05mol·L—1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L—1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是
A.+6 B.+3 C.+2 D.0
14.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
① 根据碳酸钠溶于水呈碱性,碳酸钠既属于盐,又属于碱。
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和悬浊液
④ 根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①④ D.③④
15.体积为VmL,密度为ρg·mL-1的溶液,含有相对分子质量为M的溶质mg.其溶液的物质的量浓度为cmol·L-1,质量分数为a%.下列表示式中正确的是
A.c= 1000aρ/M B.m=ρV a% C.m=1000aρ/M D.c=1000m/(V M)
16.向各盛有1L水的A、B、C、D四个烧杯中分别加入等物质的量的钠、氧化钠、过氧化钠和氢氧化钠,当固体完全溶解后,各杯溶液中溶质的质量分数的大小顺序是
A.D>C>B>A B.A>B=C>D C.B=C>A>D D.A>B>C>D
第 二 卷(非选择题 共52分)
注意事项:请用0.5毫米的黑色签字笔在二卷答题纸的指定区域内作答。
三、实验题:(本题包括2小题,共15分)
17.(2分)下列说法中,正确的是____
A.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
B.在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,需再加入蒸馏水使其液面与刻度线相平
C.用200mL量筒量取5.2mL稀硫酸
D.用托盘天平称量11.70g氯化钠固体
E.加热试管里的液体,其体积最好不要超过试管容积的1/3
F.浓硫酸不慎沾在皮肤上,立即用稀氢氧化钠溶液冲洗
G.蒸馏操作时,应使温度计水银球插入蒸馏烧瓶中液体的液面下,但不能接触瓶底
18.(13分)碳酸钠和碳酸氢钠是日常生活中常见的盐,可用作去垢和食用碱。某研究性学习小组的同学设计了下列实验用来探究、比较碳酸钠、碳酸氢钠的性质。
请回答下列问题:
⑴该小组的同学设计了如下装置进行实验:
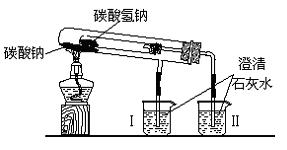
①该实验的目的是 ;
②实验过程中可以看到烧杯II中的实验现象是 ;
③加热过程中发生反应的化学方程式是: ;
⑵回答下列问题:
①若向Na2CO3的饱和溶液中通入足量的CO2气体,出现混浊,写出这个反应的化学方程式 ;
②在浓度均为1mol/L的Na2CO3和NaHCO3的溶液中分别滴加1mol/L的盐酸,起初产生气体速率快的是 ;
⑶该小组的同学在查阅资料时还得知,胃酸(主要是浓度极稀的盐酸)过多能导致人产生不适,胃酸过多的病人可服用适量的小苏打减轻不适感。
①写出小苏打和盐酸反应的离子方程式: ;
②Al(OH)3也是一种胃酸中和剂,西药“胃舒平”的主要成分就是Al(OH)3。写出Al(OH)3中和胃酸的离子方程式: ;
|
四、(本题包括4小题,共23分)
19.(6分)现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰。
请回答下列问题(用序号填写):
其中:(1)能导电的是____________
(2)属于电解质的是_____________
(3)属于非电解质的是____________
20、(6分)(1)请将3种物质:N2O、H2O、HNO3分别填入下面对应的横线上
FeSO4 + → Fe(NO3)3 + + Fe2(SO4)3 + (不必配平)
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
21.(5分)A、B、C、D、E五种物质的焰色反应都显黄色。A、B与水反应都有气体产生,A与水反应放出的气体具有氧化性,B与水反应放出的气体具有还原性,同时都生成C的溶液。C与适量的CO2反应生成D,D的溶液与过量的CO2反应生成E的溶液。请填写下列空白:
(1) B的化学式 。
(2)A与CO2反应的化学方程式 。
(3) E溶液与C溶液反应的离子方程式 。
22.(6分)类比思维是化学研究中常用的思维方法,它能帮助研究人员从一个问题出发来巧妙地解决一类本质相似的问题。已知:过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:Na2O2+CO=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2 。
试回答下列问题:
①写出Na2O2分别与SO2、SO3反应的化学方程式:
。
。
②请你总结归纳出过氧化钠与常见气态非金属氧化物发生反应的规律:
四.(本题包括2小题,共14分。)
23.(6分)(1)2.3g钠溶于_______g水中,可使Na+和H2O个数之比为1∶100
(2)向100 mL 0.1mol·L-1AlCl3溶液中逐滴滴加0.1mol·L-1的NaOH溶液,当滴加_____mL时沉淀量最多,继续滴加NaOH溶液_____mL沉淀恰好完全溶解。
24、(8分)15.8g KMnO4与100Ml 12 mol·L-1过量浓盐酸充分反应,化学方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
通过计算回答:
(1)产生的Cl 2在标准状况下的体积为多少?
(2)有多少摩尔HCl反应?其中被氧化的HCl有多少克?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
高一年级化学答题卷
三、实验题:(本题包括2小题,共15分)
17.(2分)下列说法中,正确的是____
18.(13分)⑴①该实验的目的是 ;
②烧杯II中的实验现象是 ;
③化学方程式是: ;
⑵①写出这个反应的化学方程式 ;
②产生气体速率快的是 ;
⑶①小苏打和盐酸反应的离子方程式: ;
②Al(OH)3中和胃酸的离子方程式: ;
③应选用 ,理由是 ;
四、(本题包括4小题,共23分)
19.(6分)其中:(1)能导电的是____________
(2)属于电解质的是_____________
(3)属于非电解质的是____________
20、(6分)(1) → +
(2)发生氧化反应的物质__________,被还原的元素是_________。
(3)1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
21.(5分) (1) B的化学式 。
(2)A与CO2反应的化学方程式 。
(3) E溶液与C溶液反应的离子方程式 。
22.(6分)①写出Na2O2分别与SO2、SO3反应的化学方程式:
。
。
②规律:
|
四.(本题包括2小题,共14分。)
23.(6分)(1)2.3g钠溶于_______g水中,可使Na+和H2O个数之比为1∶100
(2)当滴加_____mL时沉淀量最多,继续滴加NaOH溶液_____mL沉淀恰好完全溶解。
24、(8分)
高一年级化学答卷
选择题 1、 C 2、B 3、A 4、C 5、B 6、C 7、C 8、C
9、BC 10、D11、C 12、A等 13、B 14、B 15、BD 16、C
三、实验题:(本题包括2小题,共15分)
17.(2分)下列说法中,正确的是 A G
18.(13分)⑴①该实验的目的是 比较碳酸钠、碳酸氢钠的稳定性 ;
②烧杯II中的实验现象是 溶液变混浊 ;
③化学方程式是:
2NaHCO3 ![]() Na2CO3 + CO2
↑+ H20 ;
Na2CO3 + CO2
↑+ H20 ;
⑵①写出这个反应的化学方程式Na2CO3 + CO2 + H20 = 2NaHCO3 ;
②产生气体速率快的是NaHCO3;
⑶①小苏打和盐酸反应的离子方程式:HCO3- + H+ = H20 + CO2↑ ;
②Al(OH)3中和胃酸的离子方程式:Al(OH)3+ 3H+ = H20 + Al3+ ;
③应选用 Al(OH)3 ,理由是 小苏打与胃酸反应产生CO2气体易使胃壁穿孔 ;
四、(本题包括4小题,共23分)
19.(6分)其中:(1)能导电的是__①___④_______
(2)属于电解质的是___④_⑤_________
(3)属于非电解质的是_②_③_⑥_________
20、(6分)(1)HNO3 → N2O + H2O
(2)发生氧化反应的物质FeSO4,被还原的元素是___N____。
(3)1 mol氧化剂__得到__(填“得到”或“失去”)__4_____ mol电子。
21.(5分) (1) B的化学式 Na 。
(2)A与CO2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2。
(3) E溶液与C溶液反应的离子方程式HCO3- +OH-= H20 + CO32-。
22.(6分)①写出Na2O2分别与SO2、SO3反应的化学方程式:
2Na2O2+2SO2=2Na2SO4 。
2Na2O2+2SO3=2Na2SO4+O2 。
②规律:Na2O2与低价气态非金属氧化物反应生成正盐,与高价气态非金属氧化物反应生成正盐与氧气
|
四.(本题包括2小题,共14分。)
23.(6分)(1)2.3 g钠溶于_181.8______g水中,可使Na+和H2O个数之比为1∶100
(2)当滴加300 mL时沉淀量最多,继续滴加NaOH溶液100 mL沉淀恰好完全溶解。
24、(8分)
(1)产生的Cl 2在标准状况下的体积为5.6升。
(2)有0.8摩尔HCl,其中被氧化的HCl有18.25克。
(3)可生成100.45克沉淀。