![]() 高一化学第二学期期中试卷
高一化学第二学期期中试卷
第Ⅰ卷(共60分)
可能用到的原子量:H:1 C:12 O:16 Li:7 Na:23 Mg:24 K:39 Ca:40 Rb:85
Cs:133 Cl:35.5
一、选择题(本题包括个小题,每小题3分,共0分;每小题只有一个选项符合题意。
1. “绿色商品”是指对环境无污染的商品,下列属于 “绿色商品”的是( )
A.含氟冰箱 B.含铅汽油 C.含磷洗涤剂 D.含碘食盐
2、钠原子与钠离子比较,相同的是 ( )
A、核外电子层数 B、最外层电子数 C、能与水反应并放出H2 D、焰色反应
3、物质在化学反应前后,一定发生变化的是
A、反应前后的总能量 B、各元素的原子总数
C、反应前后的总质量 D、元素种类
4、下列氢氧化物碱性最强的是
A、KOH B、LiOH C、NaOH D、CsOH
5、 下列变化必须加入还原剂才能实现的是
A Na→Na2O2 B . Na→NaOH C . Zn→ZnCl2 D . CuO→Cu
6、下列反应中,属于氧化还原反应的是 ( )
A、Zn+2HCl=ZnCl2+H2↑ B、2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
C、CO2+ NaOH =Na2CO3+H2O D、NaHCO3+HCl=H2O+CO2↑+NaCl
7、向无色酚酞试液中逐渐加入的Na2O2粉末。肯定观察不到的现象是
A、有气泡产生 B、溶液变成红色
C、溶液先变成红色,最后褪成无色 D、溶液仍为紫色
8、下列物质热稳定性最强的是
A、石灰石 B、纯碱(Na2CO3) C、小苏打 D、碳酸氢铵(NH4HCO3)
9、下列物质露置于空气中,因氧化而变质的是
A、NaOH B、浓硫酸 C、Na2CO3·10H2O D、K
10、在强酸性溶液,下列离子组能大量共存且溶液为无色透明的是
A、Na+ K+ OH- B、Na+ Cu2+ SO42-
C、Mg2+ Na+ SO42- D、Fe2+ HCO3- Na+
11. 下列图式或符号中,能正确表示氯离子的是
A. Cl B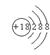 C
C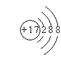 D
D ![]()
12. 下列各组离子能大量共存的是 ( )
A. Na+ CO32-- Cl-- B. Ca2+ NO3- CO32-
C. Ba2+ K+ SO4 2- D. Ag+ Cl— Na+
 13.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入少量的下列哪些物质后,发生如图所示变化①Na粒; ②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体; ⑤生石灰 ( )
13.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入少量的下列哪些物质后,发生如图所示变化①Na粒; ②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体; ⑤生石灰 ( )
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
14.下列说法正确的是
A.电解质在任何条件下都能导电
B水不属于电解质
C.在相同的条件下,强电解质溶液的导电能力强于弱电解质
D.不是电解质的物质一定是非电解质
15. 下列离子方程式错误的是 ( )
A. 实验室用启普发生器制二氧化碳气体:CaCO3+ 2H+ ==== H2O + CO2↑+Ca2+ .
B. 铁和稀硫酸反应: Fe + 2H+ ==== Fe2+ + H2↑
C. 硫酸钠溶液和氯化钡溶液反应: Ba2+ + SO42- ==== BaSO4 ↓
D. 钾放入氯化钠溶液中: K+ Na+ ==== Na + K+
16.将7.2gH2的气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 8.8g B. 3.6g C. 7.2g D.无法确定
17、将一小块金属钠投入MgCl2溶液中,最终产物是
A、Mg和NaCl B、NaOH和H2
C、O2和NaCl D、NaCl、H2和Mg(OH)2
18、关于苏打和小苏打的说法不正确的是
A、 可以用加热方法鉴别
B、相同的温度下,小苏打比苏打的溶解度小
C、相同质量的小苏打比苏打与足量稀盐酸反应时,放出的气体的质量一样多
D、在相同的条件下,加入足量稀盐酸时,小苏打比苏打放出气体的速度快
19、下列反应的离子方程式正确的是
A、Na2O2与水反应:2 O22—+2H2O==4OH-+O2↑
B. 小苏打与烧碱溶液反应 CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
C. 钾和水反应 K+2H2O![]() K++2OH-+H2↑
K++2OH-+H2↑
D. 硫酸镁溶液中加入氯化钡 Ba2++SO42-==BaSO4↓
20、下列关于铯及其化合物的说法中,不正确的是
A、氢氧化铯是一种强碱,易溶于水
B、铯与水能剧烈反应,同时生成氢气
C、用酒精灯加热碳酸铯可以生成氧化铯和CO2
D、硫酸铯、碳酸铯、硝酸铯都易溶于水
21、在甲、乙两个试管分别装入质量相等的NaHCO3固体,甲试管充分加热后冷却,再加入足量的稀盐酸;乙试管不经加热直接加入足量的稀盐酸。反应完全后,甲、乙两试管实际参加反应的盐酸的质量之比为
A、2∶3 B、1∶1 C、1∶2 D、2∶1
22、关于下列反应及其叙述中,正确的是
A、MnO2、Na2O2、H2O2都是过氧化物
B、Na2O2、Na2O都是白色固体
C、Na2O2、Na2O都能与水反应
D、Na2O2与水反应中,Na2O2是氧化剂,H2O是还原剂
23.关于钠的叙述正确的是( )
A.钠块可以用手拿取
B.钠是一种强还原剂,可以把钛、锆、铌、钽从其盐溶液中置换出来
C.钠和钾的合金常温下为液体,可作原子反应堆的导热剂
D.钠在工业上可用于生产食盐和大量制备氢氧化钠
24、当金属铷和另一碱金属组成的合金4.6克跟足量水完全反应时,产生氢气
0.1克,则合金中另一种金属不可能是: ( )
A、Na B、Li C、K D、Cs
25、在“神舟”五号飞船中,可作为宇航员供氧剂的物质是 ( )
A、Na2O B、Na2O2 C、KClO3 D、H2O2
26、吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内活性氧,则Na2SeO3的作用是( )
A、氧化剂 B、还原剂
C、既是氧化剂又是还原剂 D、以上均不是
27、下列物质的水溶液中,加入Ba(OH)2溶液后,原溶液中阴、阳离子都减少的是( )
A.H2SO4 B. KNO3 C. Na2CO3 D. FeCl3
28、下列各对物质间的反应,既属于氧化还原反应、又属于离子反应的是
A. 氯化钠与硝酸银溶液 B. 锌与稀硫酸 C.氢气还原氧化铜 D. 小苏打受热分解
29、在mR2++yH++O2==mR3++nH2O的离子方程式中,对系数m的判断正确的是
A.m=4 B.m=3 C.m=2 D.m= 1
30、在钠的焰色反应实验中,不需要的仪器或药品是 ( )
(A)铂丝棒 (B)酒精灯 (C)蓝色钴玻璃 (D)稀盐酸
33.关于锂、钠、钾、铷、铯的性质递变规律,不正确的叙述是( )。
A.单质的密度依次增大 B.单质的熔沸点依次降低
C.单质还原性依次增强 D.离子的氧化性依次减弱
二、填空题
30、(5分)实验室因保存不慎会使烧碱变质,这是因为(写离子方程式) ,为了检验一瓶烧碱溶液是否变质,应向试样中加入 ,若有 现象说明烧碱溶液已变质,为了除去变质的烧碱溶液中所含杂质而将烧碱提纯,应加入适量的试剂是: ,离子方程式: 。
32.一般治疗胃酸过多的药中都含有小苏打,但胃溃疡(胃壁溃烂或穿孔)病患者胃酸过多所服用的药剂中不能用NaHCO3,这是因为 。
18.质量相等的锂、钠、钾分别跟足量水反应,反应最剧烈的是--------------------,产生气体质量最大的是--------------------------------。
31、将相同大小的钾和钠粒同时放到上层为苯(密度为0.86g/ cm3)下层为水的试管中,已知钠的密度为0.97 g/ cm3钾的密度为0.86 g/ cm3,请问哪个先反应完全?
32、用双线桥分析下列氧化还原反应,标出电子转移的方向和数目,并指出氧化剂和还原剂。
Na2O2和水反应:
铜片插入硝酸银溶液:
三、实验题(本题16分)
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 == 2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
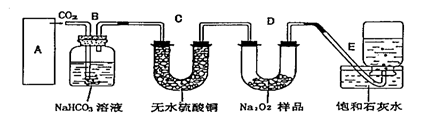
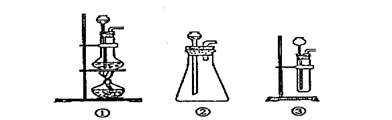
(1) A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
 |
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?
。为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)若E中石灰水出现轻微白色浑浊,请说明原因: 。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (大或小),相差约 毫升(取整数值,所用数据均在标准状况下测定),这是由于
。
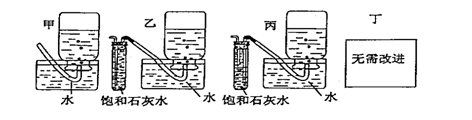 |
(5)你认为上述A---E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项: 。(用甲、乙、丙、丁回答)
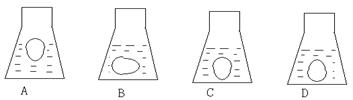
25.欲把一个洗净的鸡蛋完整放入玻璃杯中,(1)如果杯口较窄,拿着鸡蛋的手无法伸进杯中,则放入鸡蛋的正确方法是_____________________;(2)再向杯中倒入食醋,使液面高于鸡蛋约1cm,鸡蛋静止后的状态可能是下图中的_____,原因是_______________;(3)约半分钟后观察到鸡蛋表面聚集了很多气泡,并不断增多变大。气泡中的气体是______,写出发生反应的离子方程式______________;(4)过一段时间后,鸡蛋上浮,露出水面部分气泡消失,鸡蛋随即略有下沉,如此不断反复。为解释上述现象,甲、乙 、丙三位学生分别说出了三条原因,其中可能符合科学道理的是___________。
甲:生成的气体聚集在鸡蛋表面,增大了排开液体的体积;
乙:醋酸不断消耗,溶液密度减小;
丙:蛋壳发生反应,鸡蛋质量减少。
28.(9分)
(1)实验室用碳酸钙与稀盐酸反应制取二氧化碳的离子方程式是: ;
收集的方法是 ;
|
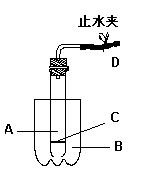
(1)该装置A应盛放 ,B处应放进 ,C应该是用 为材料做的带孔的网(或有孔的板),放置C以后使该装置具有使反应随时发生或随时停止的优点。
(2)若C是用铁丝做的网,那么发生的后果是 ,其原因是 。(填离子方程式)
(3)若使正在发生的反应停止,可以通过操作 (填字母)来实现,可看到的现象 。
23.将小苏打样品15g与足量盐酸反应,放出全部气体被过氧化钠吸收并放出2.4g氧气。试求小苏打样品的纯度。