高一化学第二学期末七校联考试题
(高一化学)
(满分:100分 时间:100分钟)
可能用到的相对原子质量:H:1 C:12 O:16 N:14 Na:23 Cl:35.5 S:32 Cu:64 Zn:65
第Ⅰ卷(选择题,共40分)
一、选择题(下列各题只有一个选项符合题意,每小题2分)
1、下列说法均摘自某科普杂志,你认为无科学性错误的是( )
①铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
②碳酸钡可作X光透视肠胃的药剂 ③实验室里向生石灰中滴加浓氨水可制取氨气 ④硅的提纯与应用,促进了半导体元件与集成芯电业的发展,可以说:“硅是信息技术革命的催化剂。”
A.①③ B.③④
C.①④ D.②③
2、质子数和电子数均相同的有 ( )
A.CH4、H2O、Na+ B. O2-、Mg2+、Ne
C.H3O+、NH4+、Na D.F2、Ar、HCl
3、下列各分子中所有原子都满足最外层为8电子结构的是( )
A.BeCl2
B.PCl
![]()
 4、科研人员最近发现放射性同位素钬
4、科研人员最近发现放射性同位素钬 ![]() 可有效地治疗肝癌。该同位素原子核内的中子数为
可有效地治疗肝癌。该同位素原子核内的中子数为
A、99
B、
5、同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是( )
A.非金属性A>B>C B.气态氢化物稳定性HA>H2B>CH3
C.原子半径A>B>C D.阴离子还原性C3->B2->A-
6、含有非极性键的离子化合物是( )
A.Na2O2 B.NaOH C.NH4Cl D.H2O2
7、已知反应:KClO3 + 6HCl= KCl + 3Cl2↑+ 3H2O,若用K35ClO3与H37Cl作用,则下列说法中正确的是( )
A.该反应中转移电子数为 6e- B.氧化产物与还原产物的质量比为5:1
C.KCl中既含35Cl又含37Cl D.KCl中只含37Cl
8、某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,wg这种元素的原子核内中子数为
A. ![]() mol
B.
mol
B. ![]() mol
mol
C. ![]() mol
D.
mol
D. ![]() mol
mol
9、铜粉放入稀硫酸中,加热后无变化,当加入一种盐后,铜粉质量减少,而溶液变蓝,同时有气体生成。此盐是 ( )
A.硝酸盐 B.硫酸盐 C.氯化物 D.碳酸盐
10、为除去CO2中混有的SO2和O2,下列试剂使用顺序正确的是( )
①饱和的Na2CO3溶液②饱和的NaHCO3溶液、③浓硫酸 ④灼热的铜网 ⑤碱石灰
A. ①③④ B.②③④ C.②④③ D.③④⑤
11、下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是( )
A.HClO B.H2O
12、用NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol·L-1稀硫酸100mL中含有硫酸根离子个数为0.1NA
B.常温常压下,氧气和臭氧的混合物
C.7.
D. NO2与足量的水完全反应,若有1molNO生成,则转移电子数为NA
13、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
14、向盐酸中加入浓硫酸会有白雾产生,下列叙述中与此现象无关的是( )
A.浓硫酸具脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气态物质的溶解度随温度的升高而降低
15、石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨
A.有放射性 B.易燃、易爆
C.能导电 D.有剧毒
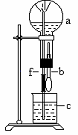
16、在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
|
| a(干燥气体) | b(液体) |
| (A). | NO2 | 水 |
| (B). | CO2 | NaHCO3溶液 |
| (C). | Cl2 | 饱和NaCl溶液 |
| (D). | NH3 | 1 mol·L-1盐酸 |
17、浓硫酸一旦不小心溅入眼睛内,首先应采取如下哪种办法进行急救( )。
A. 立即用大量清水冲洗,边冲洗边眨眼睛。
B. 先用干抹布擦,然后用水冲洗,再用3%~5%碳酸氢钠溶液清洗;
C.迅速揉搓,边搓边流泪,将酸液稀释冲出;
D. 先用 0.5%的碳酸氢钠溶液清洗,再用水冲洗;
18、在一定体积的的18mol·L-1的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,则浓硫酸的实际体积为( )
A.等于50 mL B.大于50 mL
C.等于100 mL D.大于100 mL
19、臭氧(O3)能使湿润的淀粉碘化钾试纸变蓝,化学反应式为:2KI+O3+H2O=2KOH+I2+O2, 根据上述反应,下列叙述中正确的是( )
A、O3的氧化能力大于O2
B、反应中氧化产物O2与还原产物I2的物质的量之比为1:1
C、1molO3在反应中得到6mole—
D、该反应中的还原产物是KOH
20、有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是( )
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.此实验不能确定Na2SO3是否部分被氧化
D.加硝酸后的不溶性沉淀不一定是BaSO4
![]()

七校联考试题答卷(高一化学)
可能用到的相对原子质量:H:
Cl:35.5 S:32 Cu:64 Zn:65
第Ⅰ卷(选择题,共40分)
一.选择题(选择题答案填写在下表中)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷(非选择题,共60分)
二、填空题(共48分)
21、(4分)
22、(6分)氨(NH3)是重要的含氮化合物。1774年该气体由英国普里斯特里制得。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
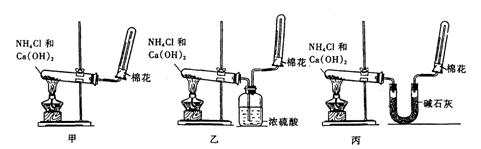
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ;
(2)写出实验室制取氨气的化学方程式 ;
(3)该实验装置与实验室制备 气的装置相同;
23、(6分)有A、B、C三种短周期元素,A原子的最外层电子数是次外层电子数的3倍,而B原子的次外层电子数是最外层的4倍,C原子的K、L层电子数之和比K、M层电子数之和多1个电子,回答下列问题:
(1)写出A、B、C元素名称:A_______、B_______、C________;
(2)B离子的结构示意图为_______________;
(3)请请用电子式表示化合物AB的形成过程: 。
24、(6分)过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂。
(1)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水的______________性。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出______________性。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌(PbSO4),在该变化过程中,H2O2作___________ 剂,有关反应的化学方程式为____________________________,在此反应中,发生转移的电子数目为_ ___。
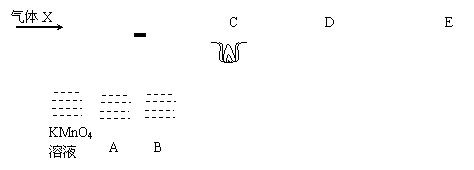
25、(6分)已知A、B、C、D、E、F是含有同一种元素的化合物,其中A是一种日常生活中不常见的红棕色气体,F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应:
A + H2O → B + C C + F → D D + NaOH![]() F + E + H2O
F + E + H2O
(1)写出它们的化学式:
A 、C 、F ;
(2)写出A + H2O → B + C的离子方程式,并指反应的氧化剂
,氧化剂
26、(10分)若物质A的水溶液可发生的一系列变化为:
 则:(1)A到F的化学式为:A
B
C
则:(1)A到F的化学式为:A
B
C
D E F
(2)A和浓硫酸反应的化学方程式为 。
检验F溶液阴离子的方法是 。
27、(10分)实验室需要
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填化学式)。产生该杂质的主要原因是 。
(2)为证实相关分析,化学小组的同学们设计了如下实验,对退回的气体(X)进行了认真探究。
![]()

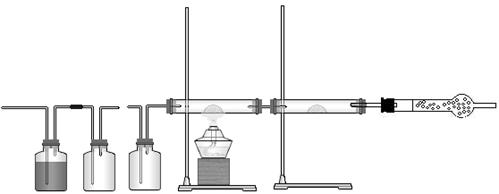
①组装好仪器后,盛放药品之前,必要的一个操作是 。
②A中的试剂可能是 ,作用是 。B中加入的试剂可能是 ,作用是 。③可证实气体X中混有较多某杂质气体的实验现象是:
C中黑色粉末 ,D中 。
④E装置的作用是: ;
三、计算题(12分)
28、(4分)将体积为V、物质的量浓度为c的K2SO4溶液与体积为V/2、物质的量浓度也为c的BaCl2溶液混合后(假设混合液的体积等于两溶液体积之和),溶液中SO42-的物质的量浓度为 ,K+的物质的量浓度为 。
29、(8分)在浓硝酸中放入铜片:
(1)若铜有剩余,则反应将要结束时的主要反应方程式是 。
(2)若反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是 。
(3)
七校联考试题答案(高一化学)
第Ⅰ卷(选择题,共40分)
一.选择题(选择题答案填写在下表中)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | B | A | C | A | D | C | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | B | A | C | D | A | D | D | C |
第II卷(非选择题,共60分)
二、填空题(共48分)
21、(4分)5NA或3.01×1024; 9:10:11
22、22、(6分)
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) “丙” ;
(2)写出实验室制取氨气的化学方程式 2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O ;
2NH3↑+CaCl2+2H2O ;
(3)该实验装置与实验室制备 氧 气的装置相同;
23、(6分)
(1)写出A、B、C元素名称:A: 氧 、B: 镁 、C: 钠 ;(每空1分)
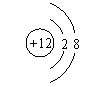 (2)B离子的结构示意图为
;
(1分)
(2)B离子的结构示意图为
;
(1分)
(3)请请用电子式表示化合物AC的形成过程: 。
(2分)
24、(共6分)(1)氧化 (2)还原 (3) 氧化 ;PbS+4H2O2=PbSO4+4H2O;8e—
25、(6分)( 每空1分,方程式2分)
(1)写出它们的化学式:
A NO2 、C HNO3 、F NH3 ;
(2)写出A + H2O → B + C的离子方程式,并指反应的氧化剂
3NO2+H2O=2H++2NO3—+NO ,氧化剂 NO2
26、(10分)(1)A到F的化学式为:
A (NH4)2SO3
(或NH4HSO3)
B (NH4)2SO
D NH3 E K2SO
(2)A和浓硫酸反应的方程式为 (NH4)2SO3 +H2SO4 =(NH4)2SO4+SO2↑+H2O。
检验F溶液阴离子的方法是先加稀盐酸,无沉淀,再加氯化钡溶液,有白色沉淀。(或其他合理答案) 。( 每空2分)
27、(10分) ( 每空1分)
(1)化学小组所制得的气体中混有的主要杂质气体可能是 H2 (填化学式)。产生该杂质的主要原因是 随着反应的进行,硫酸浓度变小 。
(2)①组装好仪器后,盛放药品之前,必要的一个操作是 检查装置气密性 。
②A中的试剂可能是 品红 ,作用是 检验SO2是否除尽 。B中加入的试剂可能是 浓硫酸(或浓磷酸) ,作用是 干燥 。
③可证实气体X中混有较多某杂质气体的实验现象是:
C中黑色粉末 变红 ,D中 无水硫酸铜变蓝 。
④E装置的作用是: 防止空气中的水蒸气进入D装置 。
三、计算题(12分)
28、(4分)将体积为V、物质的量浓度为c的K2SO4溶液与体积为V/2、物质的量浓度也为c的BaCl2溶液混合后(假设混合液的体积等于两溶液体积之和),溶液中SO42-的物质的量浓度为 c/3 ,K+的物质的量浓度为
29、(8分)在浓硝酸中放入铜片:
(1)若铜有剩余,则反应将要结束时的反应方程式是 3Cu+8HNO3(稀)=3Cu(NO3)+2NO↑+4H2O 。(2分)
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因
是 H2SO4提供H+,NO3继续与Cu发生反应: 3Cu+8H++2NO3====3Cu2++2NO↑+4H2O(意思答对即可) 。(2分)
(4)