高一化学第二学期第二次月考试题
本试卷分选择题和非选择题两部分。共100分,考试时间120分钟。
注意事项:
1 非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题纸各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
2 考生必须保持答题卡的整洁。考试结束后,将答题卡交回。
可能用到的原子量: Zn 65
第一部分 选择题(共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意。)
1 2003年IUPAC推荐原子序数为110的元素符号为Ds以纪念该元素的发现者,下列关于Ds的说法中不正确的是
A Ds原子的电子层数为7 B Ds是超铀元素
C Ds原子的质量数为110 D Ds为金属元素
一(7)班黄键
2 下列各组元素性质递变情况错误的是
A P、S、Cl 元素最高正价依次升高
B Li 、Be、 B原子最外层电子数依次增多
C N 、O、 F 原子半径依次增大
D Na、 K、 Rb的金属性依次增强
一(4)陈思
3 An+离子有m 个电子,它的质量数为A,则其原子核内的中子数为
A m+n B A-m+n C A-m-n D A+m+n
一(7)班朱远侦
4 在一定条件下,短周期元素X和Y能组成化合物X2Y,那么X和Y所在的族序数可能是
A ⅠA和ⅦA B ⅤA和ⅥA C ⅤA和ⅦA D ⅢA和ⅦA
一(7)李健龙
5 下列化合物中既含有离子健又含有非极性共价键的是
A NaOH B Na2O2 C CaCl2 D H2O2
一(9)班罗家星
6 下列关于离子键的说法错误的是
A 离子键是阴、阳离子之间的静电作用
B 离子键是阴、阳离子之间的吸引作用
C 氯离子与钙离子可形成离子键
D 氟离子与铵离子可形成离子键
一(9)班郑思敏
7 有关下列反应产物的叙述,错误的是
A 在Cl2中点燃铁丝,有FeCl2生成
B 将C12通入水中,有HCl生成
C 将Cl2通人KBr溶液中,有Br2生成
D 将Cl2通入NaOH溶液中,有NaClO生成
8 在一定条件下,反应A2(g)+B2(g)![]() 2AB(g),达到反应限度的标志是
2AB(g),达到反应限度的标志是
A 容器内气体的总压强不随时间的变化而变化
B 单位时间内有nmolA2生成,同时就有nmolB2生成
C 单位时间内有nmolA2生成,同时就有nmolAB生成
D 单位时间内有nmolB2发生反应,同时就有2nmolAB分解
9 1999年诺贝尔化学奖获得者艾哈迈德·泽维尔,开创了“飞秒化学”的新领域,使运用激光光谱技术观测化学反应时分子中的原子的运动成为可能。你认为该技术不能观察到的是
A 化学变化中反应物分子的分解 B 反应中原子的运动
C 化学变化中生成物分子的形成 D 原子核的内部结构
10 在下列描述中一定有新物质生成的是
A 有热量吸收或有热量放出的物质变化
B 碳单质石墨转化为碳单质金刚石
C 有化学键断裂的物质变化
D 将含钾元素的物质在酒精灯火焰上燃烧时,火焰显紫色
一(7)班梁永泉
11 下列各项比较中正确的是
A 熔沸点:I2>Br2>Cl2>F2 B 稳定性: HI>HBr>HCl
C 还原性:HCl>HBr>HI D 还原性:F2>Cl2>Br2>I2
12 某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断
A R一定是第四周期元素 B R一定是ⅣA族元素
C R的气态氢化物的化学式为![]()
D R的气态氢化物比同周期其它元素气态氢化物均稳定
13 某物质中只含有一种元素,则该物质是
A 一定是一种单质 B 一定是一种纯净物
C 一定是混合物 D 可能是纯净物也可能是混合物
14 一种比黄金贵百倍的![]() O2气体,近年在兰州近代物理研究所研制成功,有关
O2气体,近年在兰州近代物理研究所研制成功,有关![]() O2气体的下列说法中正确的是
O2气体的下列说法中正确的是
A 它是![]() 的一种同素异形体 B 它是
的一种同素异形体 B 它是![]() 的核素
的核素
C ![]() 与
与![]() 互为同位素 D 氧气中含有
互为同位素 D 氧气中含有![]() 分子,仍属纯净物
分子,仍属纯净物
15 下列关于化学键的说法正确的是
A 构成单质分子的微粒一定含有共价键
B 全部由非金属元素组成的化合物不一定是共价化合物
C 非极性键只存在于双原子单质分子中
D 不同元素组成的多原子分子里的化学键一定都是极性键
16 反应4NH3(气)+5O2(气) ===4NO(气)+6H2O(气)在10L容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为
A v (NH3)=0.010mol/L·S B v (O2)=0.0010mol/L·S
C v (NO)=0.0010mol/L·S D v (H2O)=0.045mol/L·S
17 镍—镉可逆电池的反应式为:Cd+2NiO(OH)+2H2O==Cd(OH)2+2Ni(OH)2,其电极的正极材料是
A Cd B NiO(OH) C Cd(OH)2 D Ni(OH)2
18 下列反应中,产生氢气速度最快的是
A 常温下铝与6mol/L的硝酸反应 B 常温下镁与3mol/L的醋酸反应
C 常温下铁与3mol/L的盐酸反应 D 常温下镁与3mol/L的硫酸反应
19 有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A D>C>A>B B D>A>B>C C D>B>A>C D B>A>D>C
20 下列说法正确的是
A 非金属元素呈现的最高化合价不超过该元素的原子的最外层电子数
B 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C 最外层有2个电子的原子都是金属原子
D 最外层有1个电子的原子都是金属原子
一(7)班雷万灏
21 下列各组物质气化或熔化时,所克服的微粒间的作用力属同一种类型的是
A 碘和干冰的升华 B 氯化钠和氯化氢溶于水
C 氯化钠和冰的熔化 D 水和钠的汽化
一(9)黄东霞
22 碱性电池具有容量大、放电电流大的特点,因而得到广泛使用锌-锰碱性电池以KOH为电解质溶液,反应总式为:
Zn (s)+ 2 MnO2 (s)+ H2O(l) = Zn(OH) 2(s) + Mn2O3 (s)
下列说法错误的是
A 电池工作时,锌失去电子
B 电池正极反应式为2 MnO2 (s)+ H2O(l) + 2e- = Mn2O3 (s) + 2OH-(aq)
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0.2mol电子,锌的质量理论上减少6.5克
一(9)班曾小燕
23 下列变化中属于吸热反应的是
① 液态水汽化 ② 将胆矾加热变为白色粉末 ③ 浓硫酸稀释
④ 氯酸钾分解制氧气 ⑤ 生石灰与水反应生成熟石灰
A ①④ B ②③ C ①④⑤ D ②④
一(9)班潘燕芬、阮雪恩
24 下列各组微粒中,核外电子总数相等的是
A K+和Na+ B CO2 和 NO2 C CO和CO2 D N2 和CO
一(9)班潘雯菲
25 以下说法与电化学腐蚀无关的是
A 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B 生铁比软铁芯(几乎是纯铁)容易生锈
C 铁质器件附有铜质配件,在接触处易生铁锈
D FeCl3溶液与铜反应制作印刷电路板
第二部分 非选择题(共50分)
二 本题包括6小题,共50分
26 (3分)已知有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有_______种元素, 种原子, 种分子。
27 (7分)下表是元素周期表的一部分,按要求回答所列有关问题。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)在所示八种元素中,最活泼的非金属元素是 ,最活泼的金属元素是 。(均填元素符号)
(2)在所示八种元素的最高价氧化物对应的水化物中,酸性最强的酸是 ,碱性最强的碱是 ,呈两性的氢氧化物是 。(均填化学式)
(3)在所示八种元素中,原子半径最小的是 ,原子半径最大的是 。(均填元素符号)
28 (8分)(1)决定化学反应速率的主要因素是 ,影响反应速率的条件有 、 、 、 等。
(2)人们使用很多方法来保存食物,如用冰箱保存食物,这是因为 。
29 (8分)根据组成原电池的条件,试以反应:Fe+Cu2+==Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
| |
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
30 (14分)现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
⑴A、B、C、D、E各是什么元素(写元素名称):
A______、B_____、C_____、D_______、E________ 。
⑵A的原子结构示意图___________,B的离子结构示意图_________
D的单质分子的电子式________, C元素最高价氧化物的水化物的电子式_______
⑶写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
___________________________,___________________
⑷比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱:(B、C、E离子用实际离子符号表示)
离子半径:____ ___ __;氧化性:_________ _________。
(5)写出E与冷水反应的化学方程式:
___________________ ________。
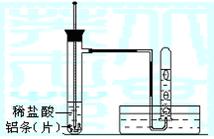
31 (10分)某课外兴趣小组欲探究铝与盐酸的反应实验中反应速率与哪些因素有关。请填写下列空白:
(1)实验原理: (用化学方程式表示)。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、 、 (填写所缺的实验用品);稀盐酸(4mol/L)、铝条(片)、水
|
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性。
②取3块铝条加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
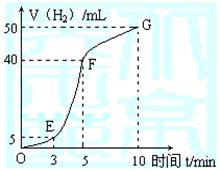
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
|
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG表示),并解释原因。
速率大小比较: ;
原因解释: 。
高一化学第二学期第二次月考试题答题卷
 第一部分 选择题(共50分)
第一部分 选择题(共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项
符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二 本题包括6小题,共50分
26 (3分) , , 。
27 (7分)(1) ,
(2) 、 、
(3) 、
28 (8分)(1) , 、 、
、
(2)
29 (8分)负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
30 (14分)(1)A______、B_____、C_____、D_______、E________ 。
⑵ ,
,
⑶ ,
。
(4) ,
(5)
31 (10分)(1)
(2) ,
(5)OE: ;EF: ;FG: 。
速率大小比较: ;
原因解释:
高一化学第二学期第二次月考试题答案
第一部分 选择题(共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项
符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | C | C | B | B | B | A | D | D | B | A | C | D |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | D | B | C | B | D | B | A | A | C | D | D | D |
二 本题包括6小题,共50分
26 (3分)3,7, 5 (各1分)
27 (7分)(每空1分,共7分)
(1)![]() ;
;![]() (2)
(2)![]() ;
;![]() ;
;![]() (3)F;
(3)F;![]()
28 (8分)(1)反应物本身的性质;温度、浓度、压强、催化剂
(2) 温度降低,食物腐败的速率降低
29 (8分)Fe (1分) Fe-2e—==Fe2+ (2分) 石墨或铜片 (1分)
 Cu2++2e—==Cu (2分) 氯化铜或硫酸铜溶液 (2分)
Cu2++2e—==Cu (2分) 氯化铜或硫酸铜溶液 (2分)
CuSO4溶液
30 (14分)(1)氧;铝;钾;碘;铯 (每空1分)
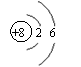 | 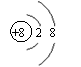 | ||||||
(2) O: Al3+
(每空1分)
(3)Al2O3+6H+=Al3++3H2O Al2O3+2OH-=2AlO2-+H2O (每空1分)
(4)Cs+>K+> Al3+ Al3+> K+> Cs+ (每空1分)
(5)2Cs+2H2O=2CsOH+H2↑ ( 1分)
31 (10分)(1)2Al+6HCl=2AlCl3+3H2↑ (1分)
(2)胶头滴管、温度计 (每空1分)
(5)5mL; 35mL;10mL。
EF>FG>OE; (每空1分)
OE段温度较低,所以此时生成氢气的速率最小;而EF段速率最大,是因为铝与盐酸反应是一个放热反应,反应一段时间后,反应体系温度升高,所以反应速率增大;FG段是由于溶液中氢离子的浓度降低,所以导致了反应速率的减小。 (3分)