高一化学第二学期限时训练试卷
说明:本试卷分第Ⅰ卷和第Ⅱ卷。考试时间:100分钟 ,满分120分。请将第Ⅰ卷选择题的答案用2B铅笔涂到答题卡上,第Ⅱ卷的答案做在答卷纸上。交卷时只交答题卡和答卷纸,试卷自己保留。
可能用到的原子量:H-1 O-16 C-12 Zn-65 Mn-55
第Ⅰ卷(选择题,共60分)
一、单项选择题(本题包括12小题,每题只有一个选项符合题意,每题2分,共24分)
1、下列化学用语正确的是
A.碳-12原子 ![]() B.羟基的电子式 ∶
B.羟基的电子式 ∶![]() ∶H
∶H
C.硫离子的结构示意图![]() D.乙烯的结构简式CH2CH2
D.乙烯的结构简式CH2CH2
2、2008夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指
A.把环境保护作为奥运设施规划和建设的首要条件
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品和食品全都是绿色的
D.奥运场馆建设均使用天然材料,不使用合成材料
3、M能层最多含有的轨道数为
A、3 B、 5 C、 7 D、 9
4、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池工作时,电子由正极通过外电路流向负极
C.电池正极的电极反应式为:
2MnO2(s)+H2O(1)+2e—== Mn2O3(s)+2OH—(aq)
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
5、在下列所示的微粒中,氧化性最强的是:
A、1S22S22P2 B、1S22S22P5 C、1S22S22P63S1 D、1S22S22P6
6、对于反应A2+3B2 ![]() 2AB3以下表示的反应速率中,速率最大的是
2AB3以下表示的反应速率中,速率最大的是
A、 v![]() =0.4mol·L-1min-1
B、vB=0.8mol·L-1min-1
=0.4mol·L-1min-1
B、vB=0.8mol·L-1min-1
C、v![]() =0.6mol·L-1min-1
D、v
=0.6mol·L-1min-1
D、v![]() =0.01mol·L-1·S-1
=0.01mol·L-1·S-1
7.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
8.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2·8H2O 与NH4Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要降温的反应就是放热反应
9、最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
10、现有乙烯和丙烯,它们进行加聚反应后,产物中可能含有:
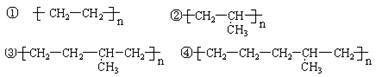
A 、只有①② B、只有①④ C、有①②③ D、全可能含有
11、甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,可依次将其通过下列哪组试剂的洗气瓶
A、澄清石灰水,浓H2SO4 B、溴水,浓H2SO4
C、酸性高锰酸钾溶液,浓H2SO4 D、浓H2SO4,酸性高锰酸钾溶液
12、某元素质量数51,中子数28,其基态原子未成对电子数为
A、0 B、1 C、 2 D、3
二、选择题(本题包括12小题,每小题3分,共36分,每小题一个或两个正确答案)
13、下列原子各电子层中电子数不合理的是
A、21Sc:K(2) L(8) M(9) N(2) B、 24Cr:K(2) L(8) M(12) N(2)
C、32Ge:K(2) L(8) M(18) N(4) D、 29Cu:K(2) L(8) M(18) N(1)
14、以下对核外电子运动状况的描述正确的是
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
15、某元素原子价电子构型3d64S2,其应在
A、第四周期ⅡA族 B、第四周期ⅡB族 C、第四周期Ⅷ族 D、第四周期ⅧB族
16、下列关于稀有气体的叙述不正确的是:
A、原子的电子排布最外层都是以P6 结束;
B、其原子与下周期ⅠA、ⅡA族阳离子具有相同电子排布式;
C、化学性质非常不活泼;
D、稀有气体也可以和其他物质发生反应
17、下列说法不正确的是( )
A.σ键是原子轨道以肩并肩方式相互重叠
B.共价化合物分子的键能越大,键越长,则分子越稳定
C.2个原子形成的多个共价键中,只能有一个是σ键,而π键可以是一个或多个
D.形成共价键时键与键重叠程度越大,体系的能量越低,键越稳定
18、下列说法中正确的是 ( )
A.第3周期所包含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
19、下列说法中错误的是
A、原子及其离子的核外能层数等于该元素所在的周期数;
B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素;
C、除氦外的稀有气体原子的最外层电子数都是8;
D、同一元素的各种同位素的物理性质、化学性质均相同
20、下列关于能层与能级的说法中正确的是:
A、原子核外电子的每一个能层最多可容纳的电子数为2n2
B、任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C、同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D、1个原子轨道里最多只能容纳2个电子,但自旋方向相同。
21、基态碳原子的电子排布式为
A、1S22S22px2 B、1S22S22py2
C、1S22S22pz2 D、1S22S22px12py1
22、当碳原子的核外电子排布由![]() 转变为
转变为
![]() 时,下列说法正确的是
时,下列说法正确的是
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态
C.产生的原子光谱为吸收光谱 D.产生的原子光谱为发射光谱
23、下列是不同能层或能级之间能量的比较和认识。不正确的是
A. E6d < E7p B. E6f > E7s
C. E3s > E2p D. 电子从3p跳到3d能级会放出能量
24、下列关于![]() 及有关数字所表示的意义说法,不正确的是
及有关数字所表示的意义说法,不正确的是
A、表示2个p轨道 B、x表示p电子云的方向
C、表示x方向的2p轨道上有一个电子 D、表示2p轨道上有x个电子
第II卷(非选择题,共60分)
三、填空题(本题共3小题,共28分)
25、(4分)按构造原理写出35号元素的基态原子的电子排布式:__________ __;其价电子层轨道表示式为___ __;最高正化合价为: _ _;其简单离子的离子结构示意图 。
26、(10分)周期表里的四种主族元素相对位置如右图所示。已知它们的原子序数总和为46,则
| m | n | ||
| x | y |
(1)元素n的原子序数为 ;
(2)用电子排布式表示x原子的价电子结构 ;
(3)m与y所形成的化合物的化学式是 。
(4)X与y相比,电负性较大的是 ,理由是 。
27、(19分)(1)①下表为烯烃类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯烃类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
据表中数据,总结烯烃类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:(4分)
____________________________________ _ _____ 。
②(2分)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
A.(CH3)2C=C(CH3) 2 B.CH3CH=CHCH3
C.CH2=CH2 D.CH2=CHCl
(2)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
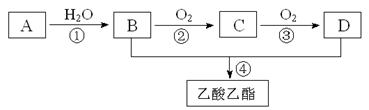
回答下列问题:
①(2分)写出A的电子式 。
②(2分)B、D分子中的官能团名称分别是 、 。
③(3分)写出下列反应的反应类型:① ,② ,④ 。
④写出下列反应的化学方程式:(6分)
① ;
② ;
④ 。
28、(5分)1932年美国化学家鲍林首先提出电负性的概念。电负性(用X表示)也是元一种衡量元素金属性和非金属的重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:请仔细分析下表数据,回答下列有关问题:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_______________________。
29、(4分)现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等能级,各能级分别有1、3、5、……个轨道。试根据电子填入轨道的顺序预测:
(1)第八周期共有 种元素;
(2)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到。试推测第114号元素属于 周期, 族元素,原子的价电子构型是 。
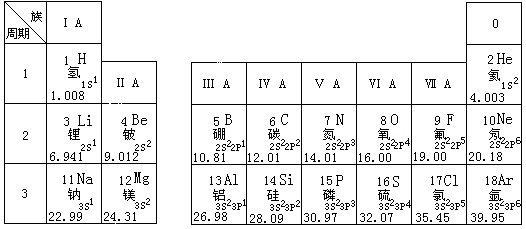 30、(6分)根据你对下列元素周期表的理解,回答有关问题:
30、(6分)根据你对下列元素周期表的理解,回答有关问题:
(1)用电子式表示上列元素中最活泼的金属元素与最活泼的非金属元素所形成化合物的过程_________________________________________________________。
(2)镁、铝最高价氧化物对应的水化物中,碱性比较强的是_____________(用化学式表示)。
(3)在ⅦA元素(Br、I分别位于第四、五周期)中,能够证明Cl2 的氧化性比I2 的氧化性强的实验是__________________________________________(用离子反应方程式表示)。
五、计算题(本题共2小题,共12分)
31、(6分)在1.01×105Pa 120℃条件下,将1L丙烷和若干升O2混合点燃,燃烧后,恢复到原来的状态,测得混合气体的体积为m L,将燃烧后的气体再通过碱石灰,气体剩余n L,已知m-n=a,请分析后填写下列空白:
(1)若a=6,则n L气体成分只能是 。
(2)若燃烧前后始终保持1.01×105Pa和120℃,则a的最大值为 ,你确定该最大值的理由是 。
32、(6分)将含过量氧气和乙烯及某烷烃组成的混合气体20L,点燃爆炸反应后,气体体积仍为20L(120℃,1.01×105Pa),然后将气体通过足量的碱石灰,剩余气体2L,若仅通过浓硫酸,则体积变为10L。求烷烃的分子式及原来乙烯的体积。
| 题 | |
| 名 姓 | 答 |
| 准 | |
| 号 学 | 不 |
| 内 线 | |
| 级 班 | 封 |
| 密 | |
| 校 学 | |
高一化学限时试卷答卷纸
25、
26、
27、(1)据表中数据,总结烯烃类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:
____________________________________ _ _____ 。
______________(填代号)。
(2)①写出A的电子式 。
②B、D分子中的官能团名称分别是 、 。
③写出下列反应的反应类型:① ,② ,④ 。
④写出下列反应的化学方程式:
① ;
② ;
④ 。
28、① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_______________________。
29、(1)第八周期共有 种元素;
(2)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到。试推测第114号元素属于 周期, 族元素,原子的价电子构型是 。
30、(1)用电子式表示上列元素中最活泼的金属元素与最活泼的非金属元素所形成化合物的过程_________________________________________________________。
(2)镁、铝最高价氧化物对应的水化物中,碱性比较强的是_____________(用化学式表示)。
(3)在ⅦA元素(Br、I分别位于第四、五周期)中,能够证明Cl2 的氧化性比I2 的氧化性强的实验是__________________________________________(用离子反应方程式表示)。
31、(1)若a=6,则n L气体成分只能是 。
(2)若燃烧前后始终保持1.01×105Pa和120℃,则a的最大值为 ,你确定该最大值的理由是 。
32、
高一化学限时训练参考答案
一、二选择题
1、A 2、C 3、D 4、B 5、B 6、D 7、C 8、B 9、B 10、C 11、B 12、D 13、B 14、CD 15、C 16、A 17、AB 18、A 19、AD 20、AB 21、D 22、AC 23、D 24、AD
三、填空题
25、1s22s22p63s23p63d104s24p5 略 +7 略
26、7 3s23p4 CCl4 y 同周期核电荷数越大,半径越小,电负性越大
27、C=C上取代基为烃基的反应速率快,烃基越多反应速率越快
C=C上取代基为卤素原子的反应速率慢,卤素原子越多反应速率越慢
D 略 羟基 羧基 加成 氧化 酯化(取代)
方程式(略)
28、F 0.8 1.2
共价键 Al的电负性为1.5,Br的电负性小于3.0,两者的差值小于1.7
29、50
七 ⅣA 7s27p2
30、略
31、CO
7 1LC3H8完全燃烧应该生成3LCO2和4LH2O
32、CH4
2L