高一化学第一学期期末调查测试试题
化 学 试 卷
第Ⅰ卷(共48分)
可能用到的相对原子质量:H-1 C-12 N-15 O-16 S-32 Cl-35.5
Na-23 Mg-24 Al-27 Fe-56 Cu-64 Zn-65
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意。)
1、硅被誉为无机非金属材料的主角。下列产品的主要成分不是硅酸盐的是
A.光导纤维 B.玻璃 C.水泥 D.陶瓷餐具
2、实验室下列物质的保存方法中,不正确的是
A.铝片放在不密封的容器里 B.氢氧化钠溶液盛装在用玻璃塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 D.金属钠保存在石蜡油或煤油中
3、分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“Na2SiO3”的分类不正确的是
A.电解质 B.硅酸盐 C.钠盐 D.碱性氧化物
4、下列事实或说法中与胶体性质无关的是
A.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
B.纳米微粒的直径与胶体粒子直径相当(1nm~100nm之间)
C.一束平行光线照射豆浆时,可看到光亮的通路
D.万里长江流入大海处,形成长江三角沙洲
5、苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
6、下列描述的一定是金属元素的是
A.易失去电子的物质 B.能与酸反应的物质
C.原子核内有11个质子的元素 D.原子最外层只有1个电子的元素
7、下列说法不正确的是
A.Na2CO3比NaHCO3热稳定性好
B.Na2CO3比NaHCO3易溶于水
C.相同条件下,Na2CO3溶液的碱性强于同物质的量浓度的NaHCO3溶液
D.用质量相同的苏打和小苏打与足量的盐酸反应可得到相同质量的CO2
8、制印刷电路时常用氯化铁溶液作为“腐蚀液”。铜被氯化铁溶液腐蚀的方程式为B2FeCl3+Cu=2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe=3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
A.、有铁、无铜 B.有铜、无铁 C.有铁、有铜 D.无铁、无铜
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
9、用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
A.氧化铝与酸不反应 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝高 D.铝箔表面温度低,未熔化
10、下列各组离子中,在强碱性溶液中能大量共存,并且溶液为无色透明的是
A.Na+、HCO3-、CO32-、K+ B.K+、Ba2+、Cl-、NO3-
C.Na+、Cl-、K+、Fe 3+ D.K+、NH4+、SO42-、Cl-
11、下列离子方程式书写正确的是
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42- =BaSO4↓
C.氨水和硫酸铝溶液反应:3OH-+ Al3+ =Al(OH)3↓
D.二氧化硅与氢氧化钠溶液反应 SiO2+2OH-=SiO32-+H2O
12、实验室有两瓶失去标签的稀硫酸和蔗糖溶液,下列鉴别方案可行的是
A.分别取少量尝一尝味道
B.取样分别加人一小片铜看有无气泡产生
C.用pH试纸测定两溶液的pH
D.取样分别加入盐酸酸化的氯化钡溶液
13、设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.常温常压下,80 g SO3含有的氧原子数为3NA
C.标准状况下,22.4 L H2中所含原子数为NA
D.一定条件下,56g铁粉与足量的Cl2完全反应转移电子数目为2NA
14、下列有关元素化合物的叙述中正确的是
A.钠在空气中燃烧生成白色的氧化钠固体
B.检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液
C.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色
D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物
15、将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
A.0.11mol B.0.05mol C.1mol D.1.05mol
16、在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断不正确的是
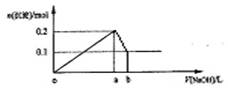 A、NaOH的浓度为0.6 mol/L
A、NaOH的浓度为0.6 mol/L
B、在a点处溶液中的溶质为NaCl
C、图中线段oa : ab=5 : 1
D、在b点处溶液中的溶质只有NaAlO2
第Ⅱ卷(共52分)
请将第Ⅰ卷选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三、(本题包含2小题,共16分)
17(7分)、某溶液中可能含有Na+、K+、ClO-、SO42-、CO32-等离子中的全部或其中的几种。为确定其成分,现进行以下的连续操作:Ⅰ:用洁净的铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;Ⅱ:取少量溶液,加入稀硫酸酸化,无气体放出,再滴入数滴品红溶液,振荡后品红褪色;Ⅲ:向Ⅱ反应后的溶液中加入Ba(NO3)2溶液,产生白色沉淀。试填写下列空白:
(1) 原混合液中一定存在的离子是 ,一定不存在的离子是 。
(2) 上述Ⅰ~Ⅲ的操作中, 是错误的,应改为加 试剂以便确定
离子是否存在。
(3) 为确定 离子是否存在,应补充的操作是 。
18(9分)、硝酸是一种挥发性强酸,而且不稳定,见光或受热时容易分解,硝酸浓度越高越易分解,分解产生NO2 、O2 、H2O。某校化学课外兴趣小组同学在做铜与浓硝酸、稀硝酸反应实验时发现:“相同质量的铜分别与等体积足量的浓硝酸、稀硝酸充分反应后,前者溶液颜色是绿色的,后者溶液的颜色是蓝色的。
(1)一种观点认为:这可能是Cu2+浓度差异所致,你同意这种看法吗?(填“同意”或“不同意”) ,原因是 ;
(2)另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确,甲、乙、丙三位同学分别设计了三种方案进行验证:
甲同学方案:将盛绿色溶液的试管加热,看是否有红棕色气体产生。
乙同学方案:用双氧水和二氧化锰制得氧气,并把氧气通入绿色溶液中,观察其溶液是否变蓝色。
丙同学方案:在通风橱内,将一根下端弯成螺旋状且可抽动的铜丝插在盛有足量浓硝酸的试管甲中,立即可观察到试管中充满红棕色的NO2气体。将气体经导管通入到倾斜的另一支盛有淡蓝色Cu(NO3)2试管乙内,随着实验进行,试管乙中的溶液蓝色加深,很快又变成绿色,继续通入NO2,绿色保持不变,向上抽起铜丝,使反应停止。
请根据以上三位同学的方案回答下列问题:
①甲同学方案有明显不妥之处。试从化学实验方案的科学性给以说明:
。
②请用化学方程式表示乙同学方案中的反应原理 。
③根据丙同学的实验方案进行操作,若出现的现象与其叙述的现象相同,则能否证明第二种观点是正确? ;
④从环保的角度看,你认为三个方案中最好的是哪一个 ,其理由是 。
四、(本题包含2小题,共20分)
19(12分)、某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有 性的次氯酸,相关反应的离子方程式为 ;
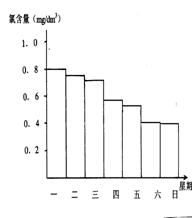 (2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。右图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。右图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;
(3)你认为哪几天的天气炎热、阳光强烈 ,说出一种理由是 ;
(4)在对泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法 。(选填序号)
A、用湿润的毛巾捂住口鼻跑向低处
B、用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C、用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D、用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液而非氯气的一项理由 ;用化学方程式说明工业上如何生产漂白液 。
20(8分)、胃酸过多是常见的胃病之一。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
、 。
五、(本题包含1小题,共8分)
21(8分)、已知在pH<7的溶液X中含有中学化学中常见的三种金属阳离子,用X溶液进行如下实验:
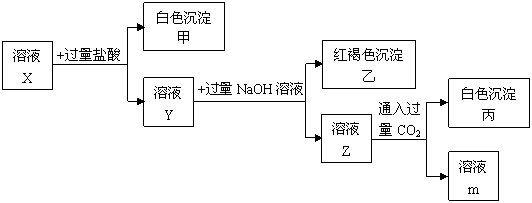 |
(1)根据有白色沉淀甲生成,判断X溶液中有 阳离子。
(2)根据有白色沉淀丙生成,判断X溶液中有 阳离子;由溶液Z生成沉淀丙的离子方程式为 。
(3)X溶液中一定含有的阴离子是 。
(4)沉淀乙的化学式为 ,该沉淀也可以通过化合反应制得,试写出该化学反应方程式: 。
六、(本题包含1小题,共8分)
|
(1)试根据相关信息判断标准状况下11.2L气体是否为纯净气体?若不是,则主要含有
气体。
(2)根据你的判断,试计算上述11.2L的气体中各成分的物质的量?
(3)计算浓硫酸的物质的量浓度为多少?
命题:高定安 张厚龙
审校:赵志明 嵇道龙
化学试卷参考答案
第Ⅰ卷(共48分)
选择题答题表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | B | D | A | B | C | D | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | AD | B | D | CD | B | BC | A | D |
第Ⅱ卷(共52分)
三、实验题
17、(1)Na+ 、ClO— ;CO32- (2)II ;HNO3或HCl ;SO42- (3) K+ ;透过蓝色钴玻璃片观察焰色。 (每空1分,共7分)
18、不同意(1分);因为铜片质量相同,溶液体积相同,生成的Cu2+浓度相同。(1分)
① 硝酸是过量的,因为硝酸受热分解会产生NO2; (2分)
② 4NO2+O2+2H2O=4HNO3; (2分)
③ 可以证明; (1分)
④ 乙同学的方案(1分);因为这个方案中没有有毒气体产生。(1分)
19、(1)强氧化 (1分); Cl2 + H2O == H+ +Cl- + HClO (2分)
(2)星期六、星期日 (2分)
(3)星期四、星期六 (2分); 阳光强烈HClO更易分解,致含氯量下降明显 (1分)
(4)B (1分)
(5)NaClO更稳定,便于储存和运输(1分);2NaOH+Cl2==NaCl+NaClO+H2O(2分)
20、(1)NaHCO3;Al(OH)3 (2)HCO3- +H+ ==CO2↑+H2O
(3)Al(OH)3 +3H+ == Al3+ + H2O;Al(OH)3 +OH- == AlO2- + 2H2O
(每空1分,方程式2分,共8分)
21、(1)Ag+(2)Al3+;AlO2- + 2CO 2 +H2O == Al(OH)3↓+ HCO3-
(3)NO3- (4) Fe(OH)3;4Fe(OH)2+O2+2H2O==4Fe(OH)3
(每空1分,方程式2分,共8分 )
22、(1)SO2 H2 (1分)
(2)n(H2)=0.2 mol; n(SO2)=0.3 mol (4分)
(3)18.2 mol/L (3分)