高一化学第一学期期末调研考试
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷满分100分。考试时间100分钟。
第Ⅰ卷(选择题 共48分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 Cl-35.5 K-39
一、单项选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.光导纤维被认为是20世纪最伟大的发明之一,它使信息高速公路在全球迅猛发展,它的发明者是被誉为“光纤之父”的华人科学家高锟。光导纤维的主要成分是
A.CaCO3 B.SiO2 C.Na2SiO3 D.CaSiO3
2.德国人弗里茨·哈伯(Fritz Haber)由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量。下列说法中正确的是
A.N2和H2在点燃或光照条件下可合成氨
B.氨是共价化合物,硝酸是离子化合物
C.氨气遇到浓硝酸会发生反应产生白烟
D.由氨制取硝酸过程中,氮元素被还原
3.下列有关实验室一般事故的预防和处理方法正确的是
A.燃着的酒精灯打翻失火,应立即用水浇灭
B.皮肤上沾有少量浓硫酸,应立即用水冲洗
C.制取并收集氧气结束后,应立即停止加热
D.蒸发溶液时有液滴飞溅,应立即加水冷却
4.下列变化中,不属于化学变化的是
A.SO2使品红溶液褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.臭氧使某些染料褪色
5.用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
A.铝箔在空气中不易燃烧 B.用酸处理时未能将氧化铝溶解
C.氧化铝的熔点比铝的熔点高 D.铝在空气中能很快形成氧化膜
6.SiO2在室温下不与水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是
A.氢氟酸的酸性比其它酸强 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.硅原子极易与氟原子结合
7.下列表示物质结构的化学用语中,错误的是
A.10个中子的氧原子的核素符号:![]() B.CO2分子的结构式:O=C=O
B.CO2分子的结构式:O=C=O
C.Cl-离子的结构示意图:![]() D.N2的电子式:
D.N2的电子式:![]()
8.下列关于浓硫酸的叙述正确的是
A.浓硫酸在常温下能够使铁、铝等金属钝化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸具有吸水性,因而能使蔗糖炭化
9.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是
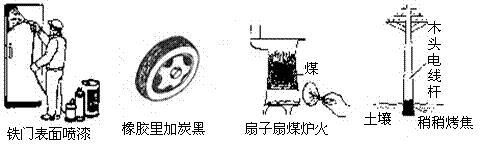 |
A B C D
10.可以鉴别LiCl、Na2CO3和KNO3三种无色溶液的方法是
A.分别加入CaCl2溶液 B.分别加入AgNO3溶液
C.分别加入HCl溶液 D.分别做焰色反应实验
二、不定项选择题(本题包括6小题,每小题3分,共18分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
11.下列物质中既含有离子键又含有共价键的是
A.NaOH B.NaCl C.H2O D.NH4Cl
12.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.0.36 g水中所含中子数一定为0.2 NA
B.
C.6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA
D.标准状况下,2.24 L氧气所含原子数一定为0.2 NA
13.下列离子方程式的书写正确的是
A.钠和水反应
2Na+2H2O![]() 2Na++2OH-+H2↑
2Na++2OH-+H2↑
B.氯气溶于水
Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.铝和氢氧化钠溶液反应 Al+2OH-![]() AlO2-+H2↑
AlO2-+H2↑
D.铁和氯化铁反应 Fe+Fe3+![]() 2Fe2+
2Fe2+
14.能在无色溶液中能大量共存的一组离子是
A.Mg2+、SO42—、OH—、K+ B.Cu2+、NO3—、Cl—、H+
C.H+、Na+、Cl—、SO42— D.K+、OH—、Cl—、NH4+
15.为探究原电池的形成条件和反应原理,某同学设计了如下实验步骤并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,正确的是
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验④说明该原电池中锌为正极、铜为负极
16.向100 mL 1.0 mol·L-1的AlCl3溶液中逐滴加入0.5 mol·L-1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是
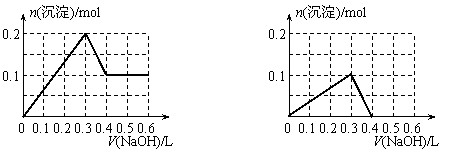 |
A B
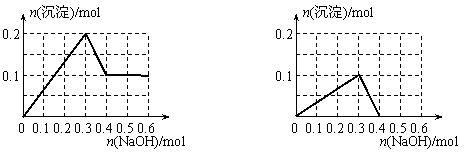 |
C D
第Ⅱ卷(非选择题 共52分)
三、(本题包括2小题,共16分)
17.(6分)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了下图1所示的装置。
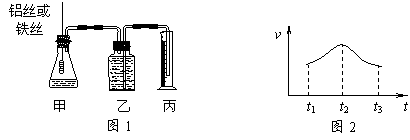 |
⑴检查图1装置气密性的方法是______________________________________。
⑵若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量___________________________________。
⑶实验测得铝丝产生气体的速率(v)与时间(t)的关系如上图2所示,则t1~t2时间内反应速率逐渐加快的主要原因是_______________________________________。
18.(10分)某同学实验室用下列装置探究氯气的性质。
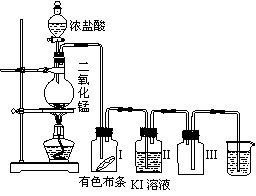 |
⑴实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并用单线桥标出电子转移的方向和数目。
⑵实验时发现有色布条褪色,其原因是______________________________________;实验结束后,要从广口瓶Ⅱ中分离出固态I2,应采用的方法是先______________,再蒸馏。
⑶烧杯中溶液的作用是_______________,广口瓶Ⅲ的作用是___________________。
四、(本题包括2小题,共22分)
19.(8分)下图中,A、B、C、D、E含有同一元素,A为红棕色固体,B为黑色粉末,C的溶液呈黄色,D的溶液呈浅绿色,E为白色沉淀且在空气中迅速转变为灰绿色最终变为红褐色。X是一种酸性稀溶液,Y是一种碱性稀溶液,其他生成物均已略去。
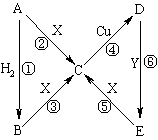
填写下列空白:
⑴A的化学式是__________,X的化学式是__________。
⑵反应④的离子方程式是__________________________________,该反应中的氧化剂是_____________。
20.(14分)下面是元素周期表的简略框架图。
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | h | i | |||||||||||||
回答下列问题:
⑴元素a在元素周期表中的位置是___________________,元素i的原子核外最外层电子数为________,元素f和h形成化合物的电子式是_____________________。
⑵元素c和g中,非金属性较强的是__________(填元素符号),支撑这一结论的化学事实是___________________________________________。
⑶写出由cd2转化为cd的化学方程式:______________________________________;b、d、e形成的一种盐俗称纯碱,其中常混有其对应的酸式盐,用化学方程式表示除去该酸式盐的方法:___________________________________________。
五、(本题包括2小题,共14分)
21.(8分)某同学按下列步骤配制500 mL 0.200 mol·L-1KCl溶液,请回答有关问题。
| 实验步骤 | 有关问题 |
| ⑴计算所需KCl的质量 | 需要KCl的质量为____________g |
| ⑵称量KCl固体 | 称量过程中主要用到的仪器是___________ |
| ⑶将KCl加入100 mL烧杯中 | 为加快溶解速率,可采取的措施是__________ |
| ⑷将烧杯中的溶液转移至500 mL容量瓶中 | 为防止溶液溅出,应采取的措施是__________ |
| ⑸向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是____________ |
你认为按上述步骤配制的KCl溶液的浓度是否为0.200 mol·L-1,请说明理由。
22.(6分)过氧化钠能与水发生反应:2Na2O2+2H2O![]() 4NaOH+O2↑。某同学用该反应制取标准状况下1.12 L氧气。
4NaOH+O2↑。某同学用该反应制取标准状况下1.12 L氧气。
⑴计算至少需要称取过氧化钠的质量。
⑵若反应所得氢氧化钠溶液的体积是200 mL,计算该溶液中溶质的物质的量浓度。
第一学期期末调研考试(高一化学)
参考答案及评分标准
一、单项选择题(本题包括10小题,每小题3分,共30分)
1.B 2.C 3.B 4.C 5.B 6.D 7.A 8.A 9.C 10.D
二、不定项选择题(本题包括6小题,每小题3分,共18分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
11.AD 12.CD 13.A 14.C 15.AB 16.D
三、(本题包括2小题,共16分)
17.⑴用手捂住锥形瓶,观察乙中长导管内液面是否上升 ⑵产生相同体积的气体所需时间 ⑶反应放热,溶液温度升高使反应速率加快 (每空2分)
![]() 18.⑴
18.⑴
4HCl+MnO2![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
⑵氯气氯气不干燥 萃取、分液 ⑶吸收多余的氯气 防止倒吸 (每空2分)
四、(本题包括2小题,共22分)
19.⑴Fe2O3 HNO3 ⑵Cu+2Fe3+![]() Cu2++2Fe2+ Fe3+或Fe(NO3)3
(每空2分)
Cu2++2Fe2+ Fe3+或Fe(NO3)3
(每空2分)
20.⑴第一周期、ⅠA族 8 ![]() ⑵N HNO3的酸性比H3PO4强或NH3的热稳定性比PH3强等 ⑶3NO2+H2O
⑵N HNO3的酸性比H3PO4强或NH3的热稳定性比PH3强等 ⑶3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
2NaHCO3![]() Na2CO3+H2O+CO2↑ (每空2分)
Na2CO3+H2O+CO2↑ (每空2分)
五、(本题包括2小题,共14分)
21.⑴7.45 ⑵天平 ⑶搅拌、加热 ⑷用玻璃棒引流 ⑸加蒸馏水至容量瓶中的液面接近刻度线1 cm~2 cm处,改用胶头滴管滴加 不是。因为该同学没有洗涤烧杯和玻璃棒 (第一空和最后一空各2分,其他每空1分)
22.解: 2Na2O2 + 2H2O ![]() 4NaOH + O2↑
4NaOH + O2↑
156 g 4 mol 22.4 L
m(Na2O2)
n(NaOH)
m(Na2O2)=![]() ×
×
n(NaOH)=![]() ×4 mol=0.2 mol (2分)
×4 mol=0.2 mol (2分)
c(NaOH)=![]() =1 mol·L-1 (2分)
=1 mol·L-1 (2分)
答:至少需要称取过氧化钠的质量为1.12 L,所得溶液的物质的量浓度为1 mol·L-1。