高一化学第一学期期末质量抽测试卷
(完卷时间:90分钟 满分:100分) .
说明:本试卷分为试题与答卷两部分,请考生将学校、班级、姓名、学号和答案写在答卷上。
相对原子质量:H-1 C-12 O-16 Na-23 Mg- 24 Cl-35.5 Br-80 Ag-108
一、选择题(每小题只有一个正确答案,每小题2分,共44分)
1.根据α粒子轰击金箔的实验现象,提出原子结构行星模型的科学家是……………( )
A、卢瑟福 B、伦琴 C、道尔顿 D、汤姆逊
2.Na和Na+含有相同的……………………………………………………………………( )
A、质子数 B、电子数 C、电子层数 D、最外层电子数
3.下列微粒的关系中,属于同位素的是……………………………………………………( )
A、金刚石、石墨 B、![]() H2、
H2、![]() H2 C、
H2 C、![]() 、
、![]() D、
D、![]() 、
、![]()
4.放射性同位素![]() 可用于治疗肿瘤。该同位素原子核内的中子数是………………( )
可用于治疗肿瘤。该同位素原子核内的中子数是………………( )
A、125 B、72 C、53 D、19
5.同温同压下,下列气体中密度最大的是………………………………………………( )
A、H2 B、O2 C、N2 D、Cl2
6.下列物质所对应的化学式属于分子式的是……………………………………………( )
A、氯化镁 B.二氧化碳 C.二氧化硅 D.硫化钠
7.下列物质中,属于含有共价键的离子化合物的是……………………………………( )
A、HCl B、H2 C、MgCl2 D、NaOH
8.X元素的一个原子失去两个电子,转移到Y元素的两个原子中去,则X、Y两种
元素形成的化合物中含有的化学键类型为……………………………………………( )
A、金属键 B、离子键
C、共价键 D、既有离子键又有共价键
9.下列变化中,只存在放热过程的是……………………………………………………( )
A、硫在空气中燃烧 B、NaOH晶体溶于水 C、液氨的挥发 D、水蒸气的液化
10.下列物质在干燥的空气中容易发生风化的是…………………………………………( )
A、石碱 B、胆矾 C、食盐 D、烧碱
11.下列变化中,需加入还原剂才能实现的是……………………………………………( )
A、![]() →CO2 B、Fe2O3→Fe C、SO2→SO3 D、C→CO2
→CO2 B、Fe2O3→Fe C、SO2→SO3 D、C→CO2
12.对于①氯化钠②金刚石③干冰三种物质的硬度由大到小排列顺序正确的是………( )
A、①②③ B、③②① C、②①③ D、②③①
13.下列变化属于化学变化的是……………………………………………………………( )
A、溴的挥发 B、碘的升华 C、氯气溶于水 D、氯的液化
14.下列物质中,含有氯离子的是…………………………………………………………( )
A、氯化氢 B、氯酸钾 C、盐酸 D、氯气
15.将新制氯水滴入下列溶液中,无明显现象的是………………………………………( )
A、溴化钠 B、硫酸钠
C、硝酸银 D、紫色石蕊
16.下列有关物质用途的叙述中,不正确的是……………………………………………( )
A、溴化银用于制胶卷 B、氢氧化钠用于制食盐
C、碘酒用来消毒 D、盐酸用于除铁锈
17.漂粉精长期露置在空气中会失效的原因是……………………………………………( )
A、吸收了氧气和水蒸气 B、吸收了二氧化碳和水蒸气
C、漂粉精风化 D、漂粉精不稳定,见光分解
18.卤族元素随着原子核电荷数的增加,下列叙述不正确的是…………………………( )
A、原子半径依次增大 B、与水反应的难度依次增加
C、单质的氧化性依次减弱 D、氢化物的稳定性依次增强
19.下列离子方程式中正确的是……………………………………………………………( )
A、铁片插入硝酸铜溶液 Fe+Cu2+→Fe3++Cu
B、石灰石和盐酸反应 CO32-+2H+→CO2↑+H2O
C、氢氧化镁与稀盐酸反应 Mg(OH)2+2H+→Mg2++2H2O
D、硫酸与氢氧化钡溶液反应 H++OH-→H2O
20.下列离子能在同一溶液中大量共存的是………………………………………………( )
A、Ba2+、K+、Cl―、SO42― B、K+、H+、Cl―、OH―
C、K+、Ag+、Cl―、NO3― D、Na+、K+、SO42―、OH―
21.电解饱和食盐水时,先要精制盐水,以除去SO42- 、 Mg2+ 、 Ca2+,通常依次加入
的溶液是…………………………………………………………………………………( )
A、BaCl2、NaOH、Na2CO3、HCl B、Na2CO3、BaCl2、NaOH、HCl
C、BaCl2、Na2CO3、HCl、NaOH D、Na2CO3、BaCl2、HCl、NaOH
22.MgCl2·xH2O的晶体2.03g与足量的硝酸银溶液反应,生成沉淀0.02mol,则
MgCl2·xH2O晶体中x的数值是…………………………………………………………( )
A、2 B、4 C、6 D、8
二、填空题(每空1分,共26分)
23.氢气在氯气中燃烧的现象为 ,生成物的结构式为 。
钠在氯气中燃烧的化学方程式为 ;生成物溶于水的电离方程式为
。
24.1mol O2的质量是 g,标准状况下的体积是 L。等物质的量的O2和CO
的质量比是 ,所含氧原子的个数比是 ,同温同压下的体积比是 。
25.有A、B、C、D、E五种元素,它们的核电荷数依次增大。已知:A失去一个电子后就成
为一个质子;B有两个电子层,其最外层的电子数是次外层电子数的2倍;C的L层得2
个电子后成为稳定结构;D是海水中含量第一位的金属元素;E的最外层电子比次外层电
子少一个。请填写下列空格:
(1)A单质的电子式 ; BC2的电子式 。
(2)D离子的结构示意图 ,D、E结合形成的化合物的电子式 。
(3)B、C、D三种元素可形成一种化合物,其化学式为 。
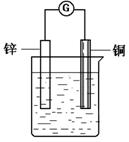 26.把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,
26.把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,
观察到的现象是 ,再用导线把锌片和铜片连接
起来,在导线中间接入灵敏电流计,灵敏电流计上观察到的
现象是 ,由此可知构成原电池的条
件是 。该原电池中电子
流动的方向是 ,总反应的化学方程式是
,
|
被氧化, 极上发生还原反应。在上述化学方程式上方
用单线桥标出电子转移的方向和数目。
27.(1)实验室电解饱和食盐水时发生反应的化学方程式为 。
在 极产生无色气体,在另一极生成的气体能使 变蓝。
 (2)研究性学习小组设计了如右图的家用消毒液发生器,通电时,发生
(2)研究性学习小组设计了如右图的家用消毒液发生器,通电时,发生
器内石墨电极上产生的氯气与电解液充分接触,制得有较强杀菌能力的
消毒液(NaClO)。则发生器内制取消毒液所涉及反应的化学方程式为
。
三、实验题(每空1分,共20分)
28.为检验某碳酸钠溶液中混有的溴化钠,进行如下实验:
| 实验步骤 | 实验现象 | 简 答 |
| 取样,加入过量的稀硝酸 | 加硝酸的目的是:
| |
| 加入硝酸银溶液 | 反应的化学方程式为:
|
29.海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:![]()
![]() 海带
海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 含I-的溶液
含I-的溶液![]() 含I2的溶液
含I2的溶液
|
(1)步骤c的操作方法是 ;除漏斗、烧杯外,还需要使用的玻璃仪器是 。
(2)步骤d所得溶液的颜色为 , 反应的离子方程式为 。
(3)步骤e中加入CCl4振荡、静置后,液体分为两层,上层液体呈 色,下层液体呈
色;步骤e的操作方法是 ,所用的主要实验仪器是 。
30.(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式
为 。
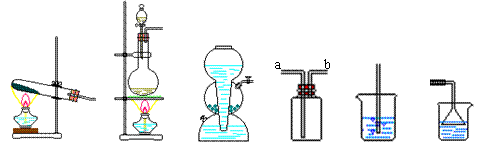 |
A B C D E F
(2)氯化氢气体的发生装置应该选择装置 (填装置的编号,下同)。由于氯化氢气体
有毒,所以实验室用装置D来收集氯化氢,则收集氯化氢时,气体从 管(填a或b)进入。用水吸收多余的氯化氢气体时,应该选择装置 ,这是为了防止 。
(3)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个干燥装置D,此时D中装入的液体应该是 。
(4)为了比较盐酸溶液与氯化氢气体性质的不同之处,取两支试管,一支滴入2~3 mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一片干燥的蓝色石蕊试纸。观察到的现象是 。再取两支试管,一支滴入2~3 mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一小块锌片。观察到的现象是 。
四、计算题(10分)
31.已知在一定条件下,甲烷和氢气燃烧的热化学方程式分别为:
CH4(g)+ 2O2(g)![]() CO2(g)+ 2H2O(l)+
890.3kJ
CO2(g)+ 2H2O(l)+
890.3kJ
2H2(g)+ O2(g)![]() 2H2O(l)+
571.6kJ。则:
2H2O(l)+
571.6kJ。则:
(1)1g甲烷完全燃烧放出的热量是多少kJ?
(2)1g氢气完全燃烧放出的热量是多少kJ?
(3)简述氢气有望成为21世纪替代矿物燃料的新能源的两条理由。
32.将7.1g氯气通入200g 20%的溴化钠溶液中,求:
(1)可生成多少克单质溴?
(2)将上述反应后所得混合溶液蒸发至干后,剩余固体混和物的成分是什么?质量分别是多少克?
高一化学第一学期期末质量抽测试卷
高一化学试卷参考答案和评分意见
一、选择题(每小题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | A | A | D | B | D | B | D | B | D | A | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | C | C | B | B | B | D | D | D | A | C |
二、填空题(每空1分,共26分)
23.安静地燃烧、产生苍白色火焰、瓶口有白雾(必须答出苍白色火焰才得分),
H-Cl。2Na+Cl2![]() 2NaCl,NaCl
2NaCl,NaCl![]() Na++Cl-
Na++Cl-
![]()
![]()
![]() 24.32g,22.4L,8:7,2:1,1:1
24.32g,22.4L,8:7,2:1,1:1
25.(1) H:H,:O::C::O:,(2) ,Na+[:Cl:]-。(3)Na2CO3。
26.锌片上产生大量气泡,电流计指针偏转。电极、电解质、导线构成闭合电路。从锌到铜(从负极到正极)。 ![]() 2SO4 → ZnSO4 + H2↑(方程式1分,电子转移的方向和数目1分)。Zn,正。
2SO4 → ZnSO4 + H2↑(方程式1分,电子转移的方向和数目1分)。Zn,正。
27.(1)2Na
Cl + 2H2O![]() 2NaOH
+ Cl2↑+ H2↑,阴,湿润的淀粉碘化钾试纸。
2NaOH
+ Cl2↑+ H2↑,阴,湿润的淀粉碘化钾试纸。
(2)Cl2 + 2NaOH → NaCl + NaClO + H2O。
三、实验题(每空1分,共20分)
28.
| 实验现象 | 简 答 |
| 产生大量气泡 | 除去CO32-,防止碳酸钠对溴化钠检验的干扰 |
| 产生浅黄色沉淀 | AgNO3 +Na Br → Ag Br↓+NaNO3 |
29.(1)过滤;玻璃棒。(2)黄(棕)色, Cl2 + 2I- →2Cl-+ I2
(3)无色,紫;萃取或分液,分液漏斗。
30.(1) NaCl(s)+ H2SO4(浓)![]() NaHSO4 + HCl↑。
NaHSO4 + HCl↑。
(2)B。a。F,水倒吸入集气瓶。(3)浓H2SO4。
(4) 盐酸中石蕊试纸变红,干燥氯化氢中试纸不变色。盐酸中锌片溶解,有气泡产生,氯化氢中锌片无变化。
四、计算题(31题4分,32题6分,共10分)
31.(1)![]() × 890.3kJ = 55.6kJ(1分);(2)
× 890.3kJ = 55.6kJ(1分);(2)![]() ×571.6 = 285.8 kJ(1分);
×571.6 = 285.8 kJ(1分);
(3)无污染、等质量时放出的热量高(2分)。
32. (1)∵![]() <
<![]() ;∴ m(Br2)=
;∴ m(Br2)= ![]() × 80×2
= 16(g) (2分)
× 80×2
= 16(g) (2分)
(2) 混合物为溴化钠和氯化钠 (2分)
m(NaBr)=200×20% -![]() ×2×103 =19.4(g)
(1分)
×2×103 =19.4(g)
(1分)
m(NaCl)=![]() ×2×58.5 =11.7(g)
(1分)
×2×58.5 =11.7(g)
(1分)
答:略