高一化学第一学期第三次同步考试试题
本卷满分120分
可能使用的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 S—32 N —14
第I卷(选择题,共60分)
一.单项选择题(本题包括10个小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.在国际单位制中,物质的量的基本单位是
A.千克 B.摩尔 C.克/摩尔 D.摩尔/升
2.金属钠、钾燃烧引起失火时,最适宜灭火的是
A.泡沫灭火器 B.液态CO2灭火器 C.大量水降温 D.干细砂
3.下列反应不属于氧化还原反应的是
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
4.在溶液导电性实验装置里,分别注入相同体积、相同浓度的醋酸和氨水灯光明亮程度相似,如果把这两种溶液混合后再实验,则
A.灯光明亮程度不变 B.灯光变亮
C.灯光明亮程度变化不明显 D.灯光变暗
5.同温同压下,相同质量的下列物质所含原子数最多的是
A.HCl B.NH3 C.H2O D.H2ClO3
6.下列有关Na2CO3和NaHCO3性质比较中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.常温时水溶液中的溶解度:Na2CO3<NaHCO3
C.与稀盐酸反应快慢:Na2CO3<NaHCO3
D.物质的量相同时,消耗盐酸:Na2CO3<NaHCO3
7.在同温同压下,A、B容器中分别充满氢气和氨气,如果它们所含的原子总数相等,则着两只容器体积比是
A.2︰1 B.1︰2 C.2︰3 D.1︰3
8.下列有关2![]() 氢氧化钠溶液的叙述,正确的是
氢氧化钠溶液的叙述,正确的是
A.把2mol氢氧化钠溶于1 L水中配制而成
B.把80 g氢氧化钠溶液配成1 L溶液
C.把40 g氢氧化钠固体溶于水,配成500m L溶液
D.把40 g氢氧化钠溶成的1 L溶液,蒸发去500 g水
9.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是
A.BaCl2溶液 B.K2SO4溶液 C.FeCl2溶液 D.NH4NO3溶液
10.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
二.多项选择题(本题包括10个小题,每小题3分,共30分。每小题有1~2个选项符合题意)
11.在无色透明酸性溶液中,能共存的离子组是
A.![]() 、
、![]() 、Al3+、Cl- B.K+、
、Al3+、Cl- B.K+、![]() 、
、![]() 、Na+
、Na+
C.Mg2+、![]() 、Cl-、Na+
D.
、Cl-、Na+
D.![]() 、K+、
、K+、![]() 、Na+
、Na+
12.下列离子方程式中正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2=2Fe3++Cl-
B.石灰石和稀盐酸反应:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.CO2通入澄清的石灰水中:Ca2++CO2+2OH- =CaCO3↓+H2O
D.NaCl溶液和AgNO3溶液混合:Ag++Cl- =AgCl↓
13.已知反应3S+6KOH(浓)![]() 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是
2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是
A.3∶1 B.1∶3 C.2∶1 D.1∶2
14.NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,11.2 L氯气所含原子数目为NA
B.2 L 0.2 ![]() K2SO4溶液SO42- 物质的量浓度为0.4
K2SO4溶液SO42- 物质的量浓度为0.4 ![]()
C.在同温同压下,相同体积的任何气体单质所含原子数目相同
D.同温、同压下,NA个CO2分子和NA个O2分子的体积相同
15.浓度为0.50![]() 的某金属阳离子
的某金属阳离子![]() 的溶液10.0mL,与0.40
的溶液10.0mL,与0.40![]() 的NaOH溶液12.5mL完全反应,生成沉淀,则n等于
的NaOH溶液12.5mL完全反应,生成沉淀,则n等于
A.1 B.2 C.3 D.4
16.将0.3![]() 盐酸100 m L与0.25
盐酸100 m L与0.25![]() 硫酸300m L混合,加水稀释至500m L,冷却,该混合液中H+的物质的量浓度是
硫酸300m L混合,加水稀释至500m L,冷却,该混合液中H+的物质的量浓度是
A.0.26![]() B.0.36
B.0.36![]() C.0.45
C.0.45![]() D.0.21
D.0.21![]()
17.向滴入紫色石蕊试液的水中加入过量的Na2O2粉末,并振荡,下列说法正确的是
A.溶液始终无色 B.溶液中有气体产生
C.溶液由紫色变为蓝色 D.溶液由紫色变蓝色最后又变无色
18.2.3 g钠投入水中,完全反应后,要使每50个水分子中含有一个钠离子,则需水质量为
A.91.8 g B.90 g C.101.8 g D.100 g
19.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
20.用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰的颜色呈浅紫色,下列说法中,正确的是
A.该溶液中的阳离子只有钾离子
B.该溶液中一定含有钠离子
C.该溶液中可能含有钠离子,但一定含有钾离子
D.该溶液中可能含有钾离子,但一定含有钠离子
第II卷(本卷60分)
 三.实验填空题(本题包括2小题,共22分)
三.实验填空题(本题包括2小题,共22分)
21.(4分)右图表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积是 mL。
22.(18分)实验室用质量分数为98%,密度为1.84![]() 的硫酸配成1
的硫酸配成1![]() 的稀H2SO4。现实验仅需要这种硫酸240 mL。试回答下列问题:
的稀H2SO4。现实验仅需要这种硫酸240 mL。试回答下列问题:
(1)配制稀硫酸时,应选用容量为 mL的容量瓶;
(2) 经计算需要 mL浓硫酸,在量取时宜选用下列量筒中的 。
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
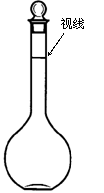 (3)配制该硫酸溶液除上述仪器外,还用到的仪器有:
。
(3)配制该硫酸溶液除上述仪器外,还用到的仪器有:
。
(4)在量取浓硫酸后,进行了下列操作:
① 待稀释的硫酸温度与室温一致后,沿玻璃棒注入容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 将浓硫酸注入盛有若干毫升蒸馏水的烧杯中,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。上述操作中,正确的顺序是(填序号) 。
(5)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会 (填“偏高”、“偏低”、“无影响”)
(6)若出现如下错误操作,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 ;加蒸馏水时不慎超过了刻度线,会 。
四.填空题(本题包括3小题,共23分)
23.(11分)物质有以下转化关系:
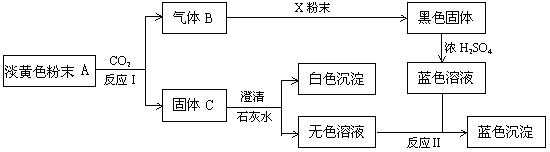
根据上图和实验现象,回答下列问题:(用化学式表示)
(1) A是 ,B是 ,C是 ,X粉末是 。
(2)确认A中阳离子的实验方法是 。
(3)写出反应Ⅰ的化学方程式 。
(4)写出反应Ⅱ的离子方程式 。
(5)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L,反应过程中转移电子的物质的量为 mol。
24.(8分)将8g氢氧化钠溶于水配制成100 m L的溶液,此溶液的物质的量浓度为________,取出10m L,此10m L溶液的物质的量浓度为________,将10m L溶液加水稀释至250 m L,稀释后溶液的物质的量浓度为________,再取稀释液10m L,用稀硫酸完全中和,需消耗.浓度为0.05![]() 稀硫酸溶液________m L。
稀硫酸溶液________m L。
25.(4分)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是 。某物质A在加热时按下式分解:2A![]() 2B↑+C↑+3D↑,现测得由生成物组成的混合气体的密度是H2的22.86倍,则反应物A的摩尔质量为 。
2B↑+C↑+3D↑,现测得由生成物组成的混合气体的密度是H2的22.86倍,则反应物A的摩尔质量为 。
五.计算题(本题包括2小题,共15分)
26.在标准状况下,用1升水吸收360升的氨气,所得溶液的密度为0.924g/ cm3。求:
(1)氨气的物质的量是多少?
(2)所得溶液的质量是多少?
(3)所得溶液的体积是多少升?
(4)溶液中质量质量分数是多少?
(5)溶液中溶质的物质的量浓度为多少?
27.将碳酸钠和碳酸氢钠的混合物27.4 g,加热到质量不再变化时剩余物质质量21.2 g。再另取试样27.4 g加入某浓度盐酸100 mL恰好完全反应。
(1) 求混合物中Na2CO3和NaHCO3各多少g?
(2) 计算盐酸的物质的量浓度。
(3) 标准状况下,试样与盐酸反应能产生CO2多少mL。
![]() 郧西县第一中学2006—2007学年第一学期第三次同步考试
郧西县第一中学2006—2007学年第一学期第三次同步考试
高一化学试题答题卷
第I卷(选择题,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
| B | D | B | B | B | C | A | C | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
| AC | CD | C | D | A | B | BD | A | A | C |
第II卷(60分)
三.实验填空题(本题包括2小题,共22分) 本题得分:
|
|

四.填空题(本题包括3小题,共23分) 本题得分
|

|

|

五.计算题(本题包括2小题,共分) 本题得分
|

|
