高一化学第一学期第二次综合练习
高 一 化 学 试 题
(考试时间:70分钟 试卷总分:100分)
命题人:田益民 审核人:杨一清 校对人:李洁
★ 请把第Ⅰ卷的正确答案填涂到答题卡上
★ 可能用到的相对原子质量:H—1 O—16 S—32 Cu—64
第Ⅰ卷 选择题(共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列气体中,不能用排空气法只能用排水法收集的是 ( )
A.NO2 B.SO2 C.NO D.NH3
2.下列物质属于纯净物的是 ( )
A.氯水 B.碳素钢 C.液氨 D.玻璃
3.下列物质的用途错误的是 ( )
A.硅是制造太阳能电池的常用材料 B.常温下可用铁罐或铝罐装运稀硝酸
C.小苏打和氢氧化铝均可治疗胃酸过多 D.工厂废气中的SO2可回收生产硫酸
4.下列存放物质的方法中错误的是 ( )
A.用棕色细口试剂瓶存放氯水 B.NaOH溶液盛装在带橡皮塞的试剂瓶中
C.漂粉精长期放置于敞口烧杯中 D.FeSO4溶液存放在含少量铁粉的试剂瓶中
5.以下转化不能通过一步反应实现的是 ( )
A. Al2O3→Al(OH)3 B.SiO2→SiF4 C.Fe→FeCl2 D.Na→NaOH
6.一定量的浓硝酸和过量的铜充分反应,生成的气体是 ( )
A.只有NO2 B.只有NO C.NO2和H2 D.NO2和NO
7.下列物质间的反应肯定无明显实验现象的是 ( )
A.加热经SO2漂白的品红试液
B.少量SO2通入浓的BaCl2溶液中
C.将新制的氯水逐滴滴入含有酚酞的烧碱溶液中
D.未经打磨的铝片加入浓NaOH溶液中一段时间
8.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了下列四种不同的方法,其中不可行的是 ( )
A.分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.关于非金属元素Si、N、S、Cl的叙述,正确的是 ( )
A.通常情况下,它们的单质均为气体 B.它们在自然界中都存在游离态形式
C.它们都有对应的含氧酸 D.每种元素都只有一种氧化物
10.下列反应中,通入的气体物质只作为氧化剂的是 ( )
A.NO2通入水中 B.Cl2通入FeCl2溶液中
C.SO2通入NaOH溶液中 D.Cl2通入KOH溶液中
11.下列说法正确的是 ( )
A.凡pH < 7的雨水就可看作“酸雨”
B.燃烧不一定要有氧气参加,但燃烧一定是氧化还原反应
C.用NaClO溶液代替Cl2作为漂白剂由于它难分解且可转化为HClO
D.“China”一词又指“青铜”,反映了在西方人眼中中国作为“青铜故乡”的形象
12.下列离子方程式正确的是 ( )
A.氯气溶于水 Cl2+H2O === 2H++Cl-+ClO-
B.碳酸钙中滴加硝酸 CO32— + 2H+ === CO2↑+H2O
C.水玻璃溶液中滴入盐酸 SiO32-+2H+ === H2SiO3↓
D.过量的氨水滴加到氯化铝溶液 Al3+ + 4OH- === AlO2- + 2H2O
13.下列有关溶液中离子的检验方法正确的是 ( )
A.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+
B.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+
C.向某溶液中滴加足量稀HCl,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32-或HCO3-
D.向某盐溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则原溶液含NH4+
14.下图所示是气体性质实验的常用装置,下列有关实验现象的说法正确的是 ( )
A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去
B.若水槽中是水,试管中是NO2,可看到液面上升并充满整个试管
![]() C.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色
C.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色
D.若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并褪为无色
15.有一无色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量Na2O2,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入Na2O2的量的关系如下图所示,根据以上判断在 ①H+ ②NH4+ ③Al3+ ④Mg2+ ⑤Fe2+
⑥NO3- ⑦SO42- ⑧CO32-中一定存在的离子是 ( )
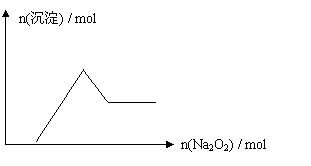 |
A.③④⑧ B.③④⑦ C.①③④⑦ D.①③④⑧
16.铜和浓硫酸共热发生如下反应:2H2SO4(浓)+ Cu![]() CuSO4 + SO2↑+ 2H2O,若6.4gCu参加反应并完全消耗,则下列说法正确的有
(
)
CuSO4 + SO2↑+ 2H2O,若6.4gCu参加反应并完全消耗,则下列说法正确的有
(
)
A.被还原的H2SO4质量为9.8g B.被还原的H2SO4质量为19.6g
C.反应过程中转移了0.1NA个电子 D.反应过程中转移了0.2NA个电子
高一化学第一学期第二次综合练习
高一化学试题答题纸
第Ⅱ卷 非选择题(共52分)
三、实验题(本题2小题,共18分)
17.(1)按要求完成下列表格:
| 实验要求 | 化学试剂 | 关键操作名称 |
| 除去SO2气体中混有的HCl | ||
| 除去SiO2固体中混有的Al2O3 |
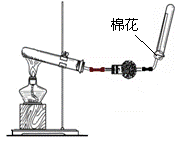 (2)右图是实验室制取氨气的装置图。
(2)右图是实验室制取氨气的装置图。
①用化学方程式表示实验室制取氨气的反应原理
。
②若试管内只装有碳酸氢铵固体,需把加热所得气体进行适当
处理可获得纯净的氨气,则在球形干燥管中装放的固体药品名称为 (装置部分夹持仪器已省去)。
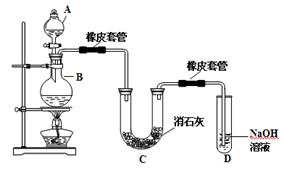 18.瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
18.瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是 ,所盛试剂是 。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(写出此反应方程式): 。
(4)2005年以来,淮安、无锡等地发生重大液氯泄漏事故。某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列处理措施不合理的是 (请填写序号 )。
①人员就近向地下商场或地铁转移
②及时用毛巾包裹活性炭捂住口鼻
③及时戴上用烧碱溶液湿润过的口罩
④液氯罐中的液氯泄漏时,可将其移入新开挖的坑塘中,并加入生石灰
四、填空题(本题2小题,共24分)
![]() 19.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
19.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试用化学方程式表示该物质的一个重要应用 。
(3)若C是红棕色气体,则A的化学式可能为 ,试写出C与水反应的化学方程式 。
![]() 20.A是一种红棕色金属氧化物,常用作油漆或涂料,C是当今用量最大的金属单质,D常温常压下为无色液体化合物,H通常状况下为黄绿色的气体单质,H在B中燃烧时火焰呈苍白色。
20.A是一种红棕色金属氧化物,常用作油漆或涂料,C是当今用量最大的金属单质,D常温常压下为无色液体化合物,H通常状况下为黄绿色的气体单质,H在B中燃烧时火焰呈苍白色。
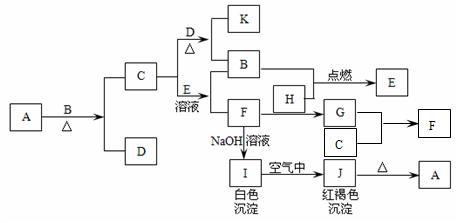
(1)写出下列物质的化学式:
A: D: E: G: 。
(2)按要求写方程式:
C与D在加热条件下生成K和B的化学方程式:
。
C可以在H中燃烧,产生棕褐色的烟,化学方程式为:
。
F和H反应生成G的离子方程式:
。
G和C反应生成F的离子方程式:
。
五、计算题(本题共10分)
21.把3.0 mol/L CuSO4溶液和2.0 mol/L H2SO4等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和)。计算:
(1)混合液中CuSO4和H2SO4的物质的量浓度;
(2)混合液中H+、Cu2+、SO42—的物质的量浓度;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余, 求此时溶液中Fe2+的物质的量浓度。
高 一 化 学 试 题 参 考 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | B | C | A | D | B | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 题号 | C | B | BC | C | BD | AC | C | AD |
17.(1)按要求完成下列表格:
| 实验要求 | 化学试剂 | 关键操作名称 |
| 除去SO2气体中混有的HCl | 饱和NaHSO3 | 洗气 |
| 除去SiO2固体中混有的Al2O3 | 稀硫酸 | 过滤 |
(2)①2NH4Cl+ Ca![]() 2
2![]() CaCl2+2H2O+2NH3↑ ②碱石灰
CaCl2+2H2O+2NH3↑ ②碱石灰
18. (1)分液漏斗 浓盐酸
(2)2Cl2 +
2Ca![]() 2===CaCl2 + Ca(ClO)2 + 2H2O
2===CaCl2 + Ca(ClO)2 + 2H2O
(3)①冰水冷却 ②2HCl + Ca(OH)2 === CaCl2 + 2H2O
(4)①③
四、填空题(本题2小题,共24分)
19. (1)2SO2+ O2![]() 2SO3
2SO3
(2)过氧化钠
2Na2O2 + 2H2O === 4NaOH + O2↑ 2Na2O2 + 2CO2 === 2Na2CO3 + O2
(3)N2 或NH3 3NO2+H2O==== 2HNO3 +NO
20. (1)A:Fe2O3 D:H2O E:HCl G:FeCl3
(2)3Fe + 4H2O![]() Fe3O4 + 4H2↑
2Fe + 3Cl2
Fe3O4 + 4H2↑
2Fe + 3Cl2 ![]() 2 FeCl3
2 FeCl3
2 Fe2+ + Cl2 === 2 Fe3+ + 2Cl— Fe + 2Fe3+ ===3 Fe2+
五、计算题(本题共10分)
21.(1)CuSO4 1.5 mol/L 、H2SO4 1 mol/L
(2)H+ 2 mol/L、Cu2+ 1.5 mol/L、SO42— 2.5 mol/L
(3)Fe2+ 2.5 mol/L