高一化学第一学期期中考试
高一化学试卷
可能用到的相对原子质量: Ar(H)=1 Ar(O)=16 Ar(Cl)=35.5 Ar(S)=32
Ar(N)=14 Ar(Zn)=65 Ar(Ba)= 137 Ar(Cu)=64 Ar(C)= 12 Ar(Mn)=55
Ar(Na)=23 Ar(I)=127
一.选择题(每小题只有一个选项符合题意。每小题2分,共20分)
1.下列物质中,同时含有氯分子、氯离子和氯的含氧化合物的是
A、氯水 B、液氯 C、氯酸钾 D、次氯酸钙
2. 在一定条件下,下列各组物质均可作氧化剂的是
A.HCl、Cl2、Na B.KMnO4、Zn、HNO3
C.FeCl3、AgNO3、Fe D.KMnO4、Cl2、O2
![]() 3. 下列反应中,离子方程式为H+ + OH- H2O的是
3. 下列反应中,离子方程式为H+ + OH- H2O的是
![]() A.CH3COOH+ NaOH CH3COONa+ H2O
A.CH3COOH+ NaOH CH3COONa+ H2O
![]() B.HNO3 + KOH KNO3
+ H2O
B.HNO3 + KOH KNO3
+ H2O
![]() C.H2SO4 +
Ba(OH)2 BaSO4↓+ 2H2O
C.H2SO4 +
Ba(OH)2 BaSO4↓+ 2H2O
![]() D.2HCl + Cu(OH)2 CuCl2
+ 2H2O
D.2HCl + Cu(OH)2 CuCl2
+ 2H2O
4. 瓦斯爆炸时发生的主要反应为:CH4+2O2→CO2+2H2O,此反应属于
A、化合反应 B、分解反应 C、置换反应 D、氧化还原反应
5. 实验室要用固体氯化钠试剂准确配制0.5L 0.2mol·L-1的NaCl溶液,下列哪种仪器不需使用的
A、500mL容量瓶 B、胶头滴管 C、试管 D、托盘天平
6. 同温、同压下决定气体体积的主要因素是
A、气体分子的直径 B、气体物质的量的多少
C、气体分子间的平均距离 D、气体分子的式量.
7. 下列物质属于纯净物的是
A.漂白粉 B.盐酸 C.碘酒 D.液氯
8. 在容量瓶上无需有标记的是
A.标线 B.温度 C.浓度 D.容量
9. 下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是
A、碘水 B、溴水 C、碘化钾溶液 D、氯气
10. 下列物质中,在标准状况下体积最大的是
A、28gN2 B、71gCl2 C、48gO2 D、1000gH2O
二. 选择题(每题有1-2个正确答案,每小题3分,共30分)
11. 所含分子数相同的一组物质是
A、1gH2和1gN2 B、1molH2O和1gH2O
C、3.2gO2和4.8gO3 D、44gCO2和16gO2
12. 下列有关0.2mol·L-1BaCl2溶液的说法不正确的是
A .500mL溶液中Cl-离子浓度为0.2 mol·L-1
B. 500mL溶液中Ba2+离子浓度为0.2 mol·L-1
C. 500mL溶液中Cl-离子总数为0.2NA
D. 500mL溶液中Ba2+和Cl-离子总数为0.3NA
13. 在含有NaCl、NaBr、NaI混合溶液中滴加足量的溴水,经充分反应后,将溶液蒸干并灼烧,残渣固体为:
A、NaCl、I2 B、NaBr、NaCl和Br2
C、NaBr、NaCl和I2 D、NaCl、NaBr
14. 为实现中国消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在.已知在溶液中IO3-可和I-发生反应:IO3-+5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是
A、①③ B、③⑥ C、②④⑥ D、①②④⑤⑦
15. 在标准状况下,如果1.6L氧气含n个氧分子,则阿伏加德罗常数的数值为
A、28n B、14n C、n/28 D、n/14
16.2005年3月29日,由山东济宁开往南京金陵石化公司的装有近30吨液氯的罐装车在京沪高速公路淮安段撞上一辆迎面驶来的货车,引起罐装液氯泄漏,造成公路旁3个乡镇的村民重大伤亡。如果你刚好住在公路旁的村子里,当你闻到氯气味时,你的选择是
A.立即关闭大门,躲到床下
B.伏倒在地,观察情况变化
C.冲出家门,向洼地转移
D.用湿毛巾捂住口腔和鼻子,朝上风口走,迅速离开村子
17.配制一定体积、一定物质的量浓度的溶液,下列情况对实验结果产生偏低影响的是
A.容量瓶中原有少量蒸馏水 B.溶解所用的烧杯未洗涤
C.定容时仰视观察液面 D.定容时俯视观察液面
18.![]() -NMR(核磁共振)可以用于含碳化合物的结构分析,
-NMR(核磁共振)可以用于含碳化合物的结构分析,![]() 表示的碳原子
表示的碳原子
A.核外有13个电子,其中4个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,核内有7个质子
D.质量数为13,核内有7个中子
19.几种微粒具有相同的核电荷数,符合该情况的是
A.可能属于同一种元素 B.一定是同一种元素
C.彼此之间一定是同位素 D.核外电子个数一定相等
20.某元素M所形成的气态单质分子M2有三种,其相对分子质量分别为70、72、74,三种分子的物质的量之比为9∶6∶1,下列说法中正确的是
A.M有三种同位素
B.M2的平均相对分子质量为72
C.质量数为35的同位素占原子总数的百分数为75%
D.M的一种同位素的质量数为37
三. 填空题
21. 要配制0.2mol·L-1的纯碱溶液500mL,在天平上称出 g碳酸钠晶体
(Na2CO3·10H2O),把称好的碳酸钠晶体放在 里,用适量 使它完全溶解,冷却到室温, 把制得的溶液沿 小心地注入 。用蒸馏水洗涤烧杯内壁 次,并把每次洗涤液都注入 ,轻轻振荡容量瓶使它里面的溶液混合均匀,缓慢地加入蒸馏水,到接近刻度线 cm时,改用 加水到刚好和刻度线 ,把容量瓶塞好,反复摇匀。(5分)
22. 选择下列实验方法分离物质,将分离方法的序号填在横线上:(5分)
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华 G.层析
⑴ 分离水和四氯化碳的混合物
⑵ 分离饱和氯化钾溶液和沙子的混合物
⑶ 从硝酸钾和氯化钠的混合溶液中获得硝酸钾
⑷ 分离酒精(沸点为为78.10C)和甲苯(沸点为110.60C)的混合物
⑸ 分离食盐和碘的混合物
23. 已知下列反应:3Fe+8HNO3 = 3Fe(NO3)2+2NO↑+4H2O (6分)
(1) __________是还原剂;__________是氧化剂。
(2)被还原的HNO3与参加反应的HNO3的质量之比为__________。
⑶当有1molHNO3参加反应时,该反应转移的电子的物质的量为__________。
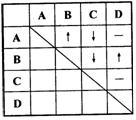 24. 为了确定四瓶失去标签的无色溶液,它们分
24. 为了确定四瓶失去标签的无色溶液,它们分
别是稀盐酸、稀硫酸、氢氧化钡和碳酸钠溶液,某同
学采用了两两混合的方法。他能将四瓶溶液分别编号为
A、B、C、D,然后各取少量在试管内两两混合,所观察
到的现象如表中所示(“—”表示无明显现象;“↓”表示
有沉淀生成:“↑”表示有气体生成。)。(8分)
(1)四种物质的化学式分别是:
A __________ B__________ C__________ D__________
(2)写出有关反应的方程式:
A+B:_______________________________________________
C+D:_______________________________________________
A+C:_______________________________________________
B+C:_______________________________________________
25. 实验室用下列仪器和药品制取干燥纯净的氯气。(12分)
(1)、按气流从左到右,装置正确的连接( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
(2)装置F的作用是 ,装置E的作用是 。
(3)装置A和E中的反应化学方程式为
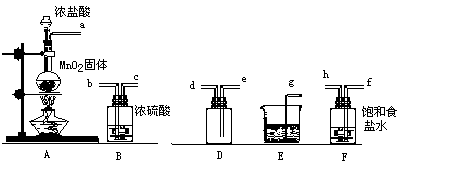 A 。E
。
A 。E
。
(4)若A中有4.48L氯气产生(标准状态下),则被氧化的HCl有 g。
(5)若有8.7gMnO2参加了反应,将产生的氯气通入足量的KI溶液中能产生单质碘的质量 g。
四、计算题(2题共14分)
26、200mL(密度为1.1g/cm3)质量分数为15%的H2SO4跟足量Zn完全反应。计算:(保留两位小数)
(1)反应生成多少升氢气(标准状况)
(2)原H2SO4溶液物质的量浓度
(3)生成ZnSO4溶液,将此溶液稀释成0.50L,求此溶液物质的量浓度
27. 100 mL某硝酸和硫酸的混合溶液中,加入50mL4 mol·L-1的NaOH溶液,正好完全中和,然后再取10 mL原混合液,加入足量BaCl2溶液,得沉淀1.165g求:
⑴原混合溶液中H+的物质的量浓度。
⑵原混合溶液中所含HNO3的质量为多少?
常州市一中2006-2007年度第一学期期中考试化学答卷纸
一. 选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二. 选择题
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
三.
21.
22. ⑴ ⑵ ⑶ ⑷ ⑸
23. ⑴
⑵ ⑶
24. ⑴A B C D
⑵A+B:_______________________________________________
C+D:______________________________________________ _
A+C:_______________________________________________
B+C:_______________________________________________
25. ⑴( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
⑵
⑶
⑷
⑸
26.
27.
参考答案
三. 选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | B | D | C | B | D | C | C | C |
四. 选择题
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | A | D | B | B | D | BC | D | A | CD |
三.
21.28.6g 、烧杯、蒸馏水、玻棒、500mL容量瓶、2-3次、容量瓶、1-2、
胶头滴管、相切
22.C、A、B、D、F
23.⑴ Fe、HNO3 ⑵ 1∶4 ⑶ 0.75mol
24. ⑴A. H2SO4 B. Na2CO3 C. Ba(OH)2 D. HCl
![]() ⑵A+B:H2SO4+Na2CO3 Na2SO4+H2O+CO2↑
⑵A+B:H2SO4+Na2CO3 Na2SO4+H2O+CO2↑
![]() C+D
Ba(OH)2+2HCl BaCl\2+2H2O
C+D
Ba(OH)2+2HCl BaCl\2+2H2O
![]() A+C:H2SO4+Ba(OH)2 BaSO4↓+2H2O
A+C:H2SO4+Ba(OH)2 BaSO4↓+2H2O
![]() B+C:Na2CO3+Ba(OH)2 BaCO3↓+2NaOH
B+C:Na2CO3+Ba(OH)2 BaCO3↓+2NaOH
25. ⑴ a接f接h接b接c接e接d接g
⑵除去混在Cl2中的HCl 吸收多余的Cl2,防止污染环境
![]() ⑶MnO2+4HCl △
MnCl2+Cl2↑+2H2O
⑶MnO2+4HCl △
MnCl2+Cl2↑+2H2O
![]() Cl2+2NaOH NaCl+NaClO+H2O
Cl2+2NaOH NaCl+NaClO+H2O
⑷ 14.6g
⑸ 25.4g
26. ⑴ 7.54L ⑵. 1.68mol·L-1, ⑶ 0.67mol·L-1
27. ⑴ 2mol·L-1 ⑵ 6.3g