高一化学第一学期期中考试试题
(时间90分钟,满分100分)
化学试卷
(2006年11月)
相对原子质量:H—1;O—16;C—12;N—14;Cl—35.5;Cu—64;S—32;Al—27;Na—23
一、选择题(每小题只有一个正确选项,每小题2分,本题共50分)
1. 美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118,中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是 ( )
A.57 B.47 C.61 D.293
2. 原子的种类决定于原子的 ( )
A.质量数 B.质子数 C.中子数 D.中子数和质子数
3. 原子核外电子是分层排布的,在不同电子层上运动着的电子能量是不同的,下列电子层上运动的电子能量最高的是 ( )
A.L层 B.K层 C.N层 D.M层
4. 化学上将质量数相同而质子数不同的原子称为同量素,如40K和40Ca。下列关于40K和40Ca的叙述中正确的是 ( )
A.40K和40Ca 具有相同的中子数 B.40K+和40Ca2+ 具有相同的电子层结构
C.39K和40K互为同素异形体 D.40K和40Ca 互为同位素
5.  下列表达式正确的是 ( )
下列表达式正确的是 ( )
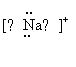 |
![]() A.N=N B.
C.
D.F—:
A.N=N B.
C.
D.F—:
6. 自然界中铱有两种质量数分别为191和193的同位素,而铱元素的相对原子质量为192.22,则这两种同位素的原子个数比应为 ( )
A.39 :61 B.61 :39 C.1 :1 D.39:11
7. 跟OH--离子中质子数和电子数都相等的微粒是 ( )
A. Na+ B. Mg2+ C.NH4+ D.F--
8. 若aAn+与 bB2—两种离子的核外电子层结构相同,则a等于 ( )
A.b+n-2 B.b-n-2 C.b+n+2 D.b-n+2
9. 放射性同位素在许多方面均有重要应用,下列选项中可能用到放射性同位素的有①育种②研究化学反应机理③保存食物④探测金属器件缺陷⑤治疗肿瘤( )
A、只有①③⑤ B、只有②④⑤ C、只有①②④ D、 ①②③④⑤
10.同温同压下,影响气体体积大小的因素是………………………………… ( )
A.气体分子本身体积 B. 气体分子间平均距离
C. 气体分子数目 D. 气体相对分子质量
11. 碳酸根离子的摩尔质量是 ( )
A.60 B.60g C.60g/cm3 D.60g/mol
12. 对于“12克碳—12”,下列说法错误的是 ( )
A.含有阿伏加德罗常数个碳原子 B.含有6个质子和6个中子
C.含有约6.02×1023个碳原子 D.含有1mol碳原子
13. 等质量的氧气和臭氧具有相同的 ( )
A.物质的量 B.原子数目 C.分子数目 D.摩尔质量
14. 下列叙述正确的是……………………………………………………………… ( )
A.在非标准状况下,1mol任何气体的体积不可能是22.4L
B.同温同压下两种气体,只要它们的分子数相同,所占体积几乎相同
C.在标准状况下,体积为22.4L的物质都是1mol
D.1mol任何气体的体积一定是22.4L
15.据报道,1994年兰州近代物理研究所制出首批重氧气(18O2),用NA表示阿佛加德罗常数,下列叙述中,正确的是………………………………………………………… ( )
A.2.0g重氧水(1H218O)所含中子数为NA B.1.8克重氧气物质的量为0.1mol
C.11.2L重氧气所含的分子数为0.5NA D.18克重氧气所含的原子数为2NA
16. Mg和Mg2+ 相同之处是 ( )
A.化学性质 B.质子数 C.核外电子数 D.物理性质
17. 22.4 L Cl2和1 mol Cl2 相比………………………………………………… ( )
A.体积一定相等 B.分子数目一定相等 C.密度可能相等 D. 质量一定相等
18. 在标准状况下,等质量的下列物质中所占体积最小的是 ( )
A.H2 B.CO2 C.H2O D.Cl2
19. 一定温度和压强下,1体积X2气体和3体积Y2气体发生化合反应后,生成2体积气体化合物,则该化合物的化学式是 ( )
A.XY3 B.X3Y C.XY2 D.X2Y
20. 同温同压下,甲乙两容器分别装有CH4和NH3气体,已知它们所含原子数相同,则甲乙两容器体积比为 ( )
A.4:3 B.5:4 C.4:5 D.1:1
21. ag NH3含b个原子,则阿伏加德罗常数可表示为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.
![]()
22. 下列各组物质中,全部以共价键结合的是( )
A.Na2S MgO HCl B.NaOH CaO N2 C.CO2 H2O Na2O D.H2S NH3 CO2
23. 用胆矾配制0.1mol/L的硫酸铜溶液,正确的操作是 ( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水当中
B.称取胆矾25g,溶解在1L水当中
C.将25g胆矾溶于水,然后将此溶液稀释至1L
D.将16g胆矾溶于水,然后将此溶液稀释至1L
24. 含有相同体积的两份植物营养液,其配方如下:
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2 mol |
| |
| (2) | 0.1 mol | 0.3 mol | 0.1 mol |
两份营养液中各离子浓度 ( )
A.完全不同 B.仅K+的浓度相同 C.仅Cl—的浓度相同 D.完全相同
25. VmL Al2(SO4)3溶液中含Al3+ ag,取![]() mL溶液稀释到4VmL,则稀释后溶液中 SO42-的物质的量浓度是 [ ]
mL溶液稀释到4VmL,则稀释后溶液中 SO42-的物质的量浓度是 [ ]
A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
二、填空题(共43分)
26. (1)人类认识原子结构的历史经历了以下几个阶段,请填写下表(3分)
| 发展阶段 | 主要化学家 | 主要贡献 |
| (1) | 道尔顿(Dalton) | |
| (2) | 葡萄干面包模型 | |
| (3) | 卢瑟福(Rutherford) | |
| (4) | 波尔(Bohr) | 现代原子论 |
(2)19世纪末20世纪初证明原子的可分性和具有更复杂结构的重要科学发现与现象是.
和
(3)1911年,新西兰出身的美国物理学家卢瑟福用а射线轰击极薄的金箔片,他惊奇地发现,过去一直是认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟为大多数a-粒子畅通无阻地通过,就象金箔不在那儿似的,但也有极少数a-粒子发生偏转,或被笔直地弹回。根据实验事实可以对金原子结构作出一些结论。
(4)现在,科学家正在探索“反物质”。“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量与相同的电量,但电性相反。已知а粒子质量数为4、带2个正电荷的氦核,据此回答:若存在反а粒子则其组成可以表示为 。
27. 将某文献资料上记载的相对原子质量数据摘录如下:
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.966 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
试回答下列问题:
(1)34.969是表示_______________;
(2)35. 485是表示_______________;
(3)列出求算35. 485的算式_______________;
28. 等温等压下,等物质的量的CO和C02,它们的体积比是 ,其中氧原子数之比是 ,密度比是 。
29. 工业上最早在19世纪中叶便已生产的过氧化氢,目前已经成为社会需求量迅速增长的化学品。原因是它在使用时,很少产生污染。在过氧化氢分子中,一个过氧键:-O-O-(短线表示一对共用电子对),每个氧原子各连着1个氢原子。纯的过氧化氢是蓝色粘稠液体,沸点152.1 0C,冰点-0.89 0C。
(1)写出过氧化氢的化学式 。
(2)过氧化氢是 化合物(填离子或共价)。
(3)写出过氧化氢分子的电子式:
(4)过氧化氢分子中氧元素的化合价是
30. 有A、B、C、D、E五种微粒(原子或离子),已知:
A原子核外M电子层上有2个电子;
B原子得到2个电子后,其电子层结构与Ne相同;
C离子带有一个单位的正电荷,核电荷数为11;
D离子核外有18个电子,质子数比电子数少一个;
E微粒不带电,其质量数为1。
试回答下列问题:
(1)依次写出A、B、C、D、E各微粒的符号
A 、B 、C 、D 、E ;
(2)C、D所属元素组成的化合物是 化合物(填共价或离子),用电子式表示其形成过程: ;
31. 某学生配制250mL 0.100mol/L的氢氧化钠溶液。配制过程如下:
(1)在 上称取 g氯化钠晶体,放入 中,用适量的蒸馏水溶解,冷却至室温,然后将溶液小心转移入 中,振荡,使溶液均匀混合,然后缓缓把蒸馏水注入瓶中,直到液面 ,改用 加水到刻度线,使溶液的 正好与刻度线 ,最后塞好瓶塞,反复摇匀。
(2)以上操作过程是否正确? 。若不正确,请指出不适之处 (3)可能造成溶液浓度偏低的操作 (例举2个操作即可,多了不加分)
三、计算题(共7分)
32. 250ml 15% 的硫酸(密度为1.1 g/cm3)跟25g铁屑充分反应,计算:
(1) 这种硫酸的物质的量浓度;
(2) 制得氢气(标准状况下)体积;
(3) 把生成的硫酸亚铁配制成400mL溶液,这溶液的物质的量浓度是多少?
高一化学第一学期期中考试试题
化学答题纸
| 发展阶段 | 主要化学家 | 主要贡献 |
| (1) | 道尔顿(Dalton) | |
| (2) | 葡萄干面包模型 | |
| (3) | 卢瑟福(Rutherford) | |
| (4) | 波尔(Bohr) | 现代原子论 |
26.(1)
(2) 和
(3)
(4)
27.(1) ;(2)
(3)
28. , ,
29. (1) (2) (3) (4)
30. (1)A. B. C. D. E。
(2) ,
31.(1) , g, , 中,
, , , ,
(2) 。 ,
(3)
32.
化学试卷答案
一、选择题:ADCBD ADCDC DBBBA BCCAC CDCDC
二、填空题(每空1分,除特殊注明外)
| 发展阶段 | 主要化学家 | 主要贡献 |
| (1) | 道尔顿(Dalton) | 近代原子论 |
| (2) | 汤姆逊 | 葡萄干面包模型 |
| (3) | 卢瑟福(Rutherford) | 原子结构的行星模型 |
| (4) | 波尔(Bohr) | 现代原子论 |
26.(10分)
(2) 电子的发现 和 放射性的发现
(3)(3分)原子核带正电;原子核是一个体积很小而又很坚硬的不能穿透的核;原子几乎是一个中空的球体;(核外电子在核四周作高速运动)
(4)![]() He2-(2分)
He2-(2分)
27.(3分)(1)同位素35Cl相对原子质量;(2)氯元素的近似相对原子质量;
(3)35×75.77%+37×24.23%
28.(3分) 1:1 , 1:2 , 7:11
29(5分)(1)H2O2 (2)共价 (3) (2分) (4)-1
30.(8分)(1)A Mg 、B O 、C Na+ 、D Cl- 、E H ;
(2)离子, (2分)
31.(14分)(1) 电子天平 , 1.000 g, 烧杯 , 250mL容量瓶(2分) 中,
距刻度线2~3厘米 , 胶头滴管 , 凹液面 , 相切 ,
(2)不正确 。
①应用玻璃棒引流
②应洗涤烧杯和玻璃棒2到3次并将洗涤液一并转移到容量瓶中(2分)
(3) 合理给分,各1分 (2分)
32.(7分)
(1)1.68mol/L
(2)9.43L
(3) 1.05 mol/L