高一化学第一学期期中考试试题
总分:100分 考试时间90分钟
相对原子质量:H:1 O:16 S:32 Na:23 Al:27 Fe 56 Cu:64
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个正确选项)
1、下列名词中,哪个名词不属于物理量
A、摩尔 B、 质量 C、长度 D、 时间
2.从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是
A.Na B.NaCl C.NaOH D.Na2O
3 下列叙述正确的是
A.SO3的水溶液能导电,所以SO3是电解质
B.氯化钠溶液能导电,所以氯化钠溶液是电解质
C.氯化钠晶体不导电,但是氯化钠是电解质
D.液态氯化氢不能导电,所以氯化氢不是电解质
4 用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水的 C、用欲配制的溶液润洗过的 D、以上三项均须要求的
5、用铂丝做焰色反应实验,每次做完后都需要
A、用水洗涤2~3次后再使用
B、用滤纸擦干净即可使用
C、用盐酸洗涤,再用自来水洗净后使用
D、用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用
6 下列反应的离子方程式正确的是
A.钠与水反应:2Na+2H20=2Na++OH-+H2 ↑
B.钠与CuS04溶液反应:2Na+Cu2+ == Cu↓+2Na+
C.NaHC03溶液与稀H2SO4反应:CO32-+2H+==H2O+CO2↑
D.NaOH溶液与小苏打溶液反应:HCO3-+OH-==CO32-+H20
7、下列实验操作中正确的是
A.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
B.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
C.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
8、用胆矾(CuSO4·5H2O)配制0.1mol/L的硫酸铜溶液,下列操作中正确的是:
A.取25 g胆矾溶于1 L水中
B.取16 g胆矾溶于水配成1 L溶液
C.取25 g胆矾溶于水中配成1 L溶液
D.将胆矾加热除去结晶水,再取无水硫酸铜16 g溶于1 L水中
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得3分,)
9. 2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题“水利发展与和谐社会”。下列有关水的化学反应中,水既不是氧化剂也不是还原剂的氧化还原反应是
A 2Na+2H2O=2NaOH+H2↑ B. 3Fe+4H2O(g)
![]() Fe3O4+4H2
Fe3O4+4H2
C.CaO+H2O=Ca(OH)2 D.Cl2+H2O=HCl+HClO
10、有关胶体和溶液的叙述正确的是
A、直径介于1nm~100nm之间的微粒称为胶体 B、胶体是混合物
C、胶体微粒不可以通过滤纸 D、利用丁达尔效应可以区别胶体和溶液
11 用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L水含有6.02×1022个水分子
B.氧气和臭氧的混合物1.6 g中含有6.02×1022个氧原子
C.7.8 g Na2O2与水反应时转移6.02×1022个电子
D.1.12 L氯气中含有6.02×1022个氯原子
12 .用右图表示的一些物质或概念间的从属关系中不正确的是
| X | Y |
| |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 金属氧化物 | 碱性氧化物 | 氧化物 |
13.某无色透明的酸性溶液中能大量共存的一组离子是
A.NH4+ 、CO32-、Al3+、Cl- B.Na+、HCO3-、K+、SO42-
C.MnO4-、K+、SO42-、Na+ D.Mg2+、Na+、SO42-、NO 3-
14、判断NaHCO3粉末中混有Na2CO3的方法是
A.加热观察有无气体放出 B..加入CaCl2溶液中观察有无沉淀生成
C.加入澄清石水中观察有无沉淀产生 D.加入盐酸中观察产生气体的速度
15、下列氯化物,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
16、 某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸,所得溶液与原溶液相比,溶液中大量减少的阳离子是
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
第Ⅱ卷(非选择题 共52分)
三、(本题包括2小题,共13分。)
17.选择下列实验方法分离物质,将分离方法的序号填在横线上:
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华 G.渗析
(1) 分离水和四氯化碳的混合物;
(2) 分离饱和氯化钾溶液和沙子的混合物;
(3) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(4) 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5) 从碘水中提取碘单质。
18.用98%的浓硫酸(其密度为1.84g/cm—3)配制100mL1.0mol·L-1稀硫酸。
(1)需量取浓硫酸的体积为 mL(保留一位小数)。
(2)若实验仪器有:
(A)100mL量筒 (B)托盘天平 (C)玻璃棒 (D)50mL容量瓶 (E)10mL量筒 (F)胶头滴管 (G)50mL烧杯 (H)100mL容量瓶
实验时选用的仪器除C、F、G外还应选用(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
(A)定容时俯视刻度线观察液面;(B)容量瓶使用时未干燥;(C)定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶的使用中,下列操作不正确的是(填序号)
(A)使用容量瓶前检查它是否漏水
(B)容量瓶用蒸馏水洗净后,不用待配制的溶液洗涤
(C)将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
(D)将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
(E)定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
四、(本题包括2小题,共12分)
19、(1)下列物质能导电的是 ,属于电解质的是 ,属于非电解质的是 。
①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖
(2)按要求写出下列方程式:
① KAl(SO4)2电离的电离方程式:
② 小苏打电离的电离方程式:
③ 碳酸钙与盐酸反应的离子方程式:
(3)酸与碱发生中和反应的实质是____________ (用离子方程式表示)
20.运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题
过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2+2CO=Na2CO3。
(1) 试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
。
(2) 通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。
五(本题包括2小题,共14分)
21、甲、乙、丙三种物质之间有如下转化关系:
![]()
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是 。
写出“乙![]() 丙”转化的化学方程式:
。
丙”转化的化学方程式:
。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是: 。
写出“甲![]() 乙”转化的离子方程式:
。
乙”转化的离子方程式:
。
22.有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、K+、NO3-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
 |
第②个实验中加入Ba(NO3)2溶液生成白色沉淀 第③个实验中,生成白色沉淀的量
与加入NaOH的量有右图所示的相互关系。据此可知:
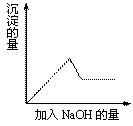 ⑴在原溶液中一定不存在的离子有_____________________,
⑴在原溶液中一定不存在的离子有_____________________,
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________ 和_________。
⑶写出第③个实验中发生反应的离子方程式
。
。
。
六、(本题包括2小题,共13分)
23.已知HCl与NaOH完全中和时,两者的物质的量之比为1∶1。现有某NaOH溶液100mL,其中含溶质8g,加水将该氢氧化钠溶液稀释至1000mL,取稀释后的NaOH溶液500mL,恰好与100mL的盐酸完全反应,试求这种盐酸溶液溶质的物质的量浓度。
24.向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,求原溶液中Fe3+的物质的量浓度。
参考答案
1 A 2 B 3 C 4 B 5 D 6 D 7 C 8 C 9 D 10 BD 11 B C 12 C D 13 D 14 B 15 D 16 B C
17 C、A、B、D、E
18.(1)5.4 (2)EH (3)A (4)CD
19(1)①⑤;②④;⑥⑦
(2)①KAl(SO4)2==K++Al3++2SO42-
②NaHCO3=Na++HCO3— ③CaCO3+2H+= Ca2++H2O+CO2↑
(3) H++OH—=H2O
20.(1) SO2+Na2O2=Na2SO4;2SO3+2Na2O2=2Na2SO4+O2;(2) 最高
21、(1)甲是 Al2O3 。
化学方程式: Al2SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
(2)甲物质是: Fe2O3 。
离子方程式: Fe2O3+6H+=2Fe3++3H2O 。
22(1)Fe3+、Fe2+、Cu2+、
(2)KAl(SO4)2(或KAl(SO4)2·12H2O) MgSO4 (3)Mg2++2OH-=Mg(OH)2↓
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
23.根据稀释前后,溶质的物质的量不变可得,稀释后的NaOH溶液500mL中含NaOH的物质的量为:
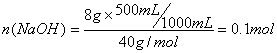
根据题意可知,100mL的盐酸中所含溶质HCl的物质的量也为0.1mol,所以盐酸溶液溶质的物质的量浓度为:
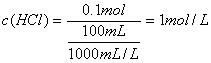
答:所求盐酸溶液溶质的物质的量浓度为1mol/L。
24.解:因为:Fe3+ +3OH—=Fe(OH)3↓(1分), Al3+ +3OH—=Al(OH)3↓,
Al(OH)3+3OH—=AlO2—+2H2O(1分) 根据物质的量比得:
|
b—a= n(Al3+) ……………………………….
解得:n(Fe3+)]=(4a/3-b)mol/L ……………………………….….
 Z
Z