高一化学第一学期期中考试题
高 一化学
命题人:金彤彬
注意:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共6页,22道题。
满分值:75分,考试时间:90分钟。考生只交第Ⅰ卷答题卡和第Ⅱ卷。
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 F:19 K:39 Cu:64 N:14 C:12 O:16 S:32 Cl:35.5 Br:80
第Ⅰ卷(共44分)
一、选择题(本大题共22小题,每题2分,共44分。每题有一~~~~二项符合要求)
1.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的 ( )

2.下列物质按纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A.盐酸、水煤气、硫酸钡、干冰 B.氢氧化钠、液氨、碳酸钠、乙醇
C.胆矾、豆浆、氯化铵、氧化铁 D.金刚石、空气、石灰石、蔗糖
3.“纳米材料”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是 ( )
A.能全部透过半透膜 B.有丁达尔效应
C.所得溶液一定能导电 D.所得物质一定为悬浊液或乳浊液
4.下列仪器:①漏斗、②容量瓶、③蒸馏烧瓶、④天平、⑤分液漏斗、⑥滴定管、
⑦燃烧匙,常用于分离物质的是 ( )
A. ①③④ B. ①②⑥ C. ①③⑤ D. ③④⑦
5.下列反应可以用同一离子方程式表示的是 ( )
A.HCl+Na2CO3 HCl+NaHCO3 B.NaOH+HCl Ba(OH)2+H2SO4
C.BaCl2+H2SO4 Ba(OH)2+Na2SO4 D.CaCO3+HCl Na2CO3+H2SO4
6.下列叙述正确的是 ( )
A.金属阳离子被还原后,一定得到该元素的单质
B.失电子难的原子获得电子的能力一定强
C.阳离子只有氧化性,阴离子只有还原性
D. 含有最高价元素的化合物不一定具有强的氧化性
7.下列各溶液中, C(Na+)物质的量浓度最大的是 ( )
A. 4L 0.5mol/LNaCl溶液 B. 1L 0.3mol/LNa2SO4溶液
C. 5L 0.4mol/LNaOH D. 2L 0.15mol/LNa3PO4
8.下列是有关实验操作的步骤和做法,不正确的是 ( )
A. 粗盐提纯操作顺序是:溶解、过滤、蒸发、洗涤,且四次用到玻璃棒
B. 实验室制取O2完毕后,应先取出集气瓶,再取出导管,后停止加热
C. 不慎将浓酸洒在桌面上,应先用烧碱溶液中和,再用湿布抹净
D. 用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部
9.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的
水溶液,分离以上各混合液的正确方法依次是 ( )
A . 分液、蒸馏、萃取 B. 萃取、蒸馏、分液
C . 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
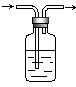 10.化学实验中的很多气体是用盐酸来制取的,这就导致了
10.化学实验中的很多气体是用盐酸来制取的,这就导致了
这些制取的气体中往往含有HCl杂质,要除去HCl杂质而
得到纯净的目标气体,可用右图所示装置。如果广口瓶中
盛装的是饱和NaHCO3溶液,则可以用于下列哪种气体的
除杂装置是 ( )
A.H2 B. O2 C. H2S D.CO2
11. 某无色溶液能与镁粉作用产生氢气,此溶液中可能大量存在的离子组是 ( )A.H+、Na+、CI-、SO![]() B.K+、Ba2+、A13+、CO
B.K+、Ba2+、A13+、CO![]()
C.A13+、Fe3+、HCO![]() 、SO
、SO![]() D.Ca2+、H+、C1-、NO3-
D.Ca2+、H+、C1-、NO3-
12. 下列反应的离子方程式正确的是
( )
A.把金属铁放入稀硫酸中 2Fe+6H+=2Fe3++3H2↑
B.亚硫酸钡与盐酸反应:BaSO3+2H+=Ba2++SO2↑+H2O
C.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++![]() == BaSO4↓+2H2O
== BaSO4↓+2H2O
D.烧碱溶液中通入少量的CO2. CO2+OH-=HCO3-
13. 同一物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是 ( )
A.2KNO3=2KNO2+O2↑
B.NH4HCO3=NH3↑+CO2↑+H2O
C.3NO2+H2O=2HNO3+NO D. SO2+2H2S=3S+3H2O
14. 某溶液含有CO32-、HCO3-、S2-、CH3COO-、PO43-五种阴离子。向上述溶液中加入过量盐酸后,上述阴离子数目会减少的是 ( )
A. CO32-和HCO3- B. CO32-,HCO3-和S2-
C. CO32-,HCO3-,S2-,CH3COO-
D. 全部
15.下列各组溶液不用其他试剂就可以区别开的是
( )
A.BaCl2 Na2SO4 CaCl2 NaNO3 B. NaOH MgSO4 Na2CO3 H2SO4
C.FeCl3 Na2SO4 CaCl2 NaNO3 D. H2SO4 NaOH HCl Na2CO3
16.下列说法正确的是 ( )
A.CO2的摩尔质量等于CO2的相对分子质量
B.在标准状况下,22.4L水的质量约为18g
C.在同温同压下,相同体积的任何气体单质所含的原子数相同
D.2.4g金属镁所含电子的物质的量为1.2mol
17. 两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内
的气体一定具有相同 ①.原子总数 ②.质子总数 ③.分子总数 ④.质量 ( )
A. ①② B ②③ C ①③ D ②④
18.已知化学反应5NH4NO3![]() 2HNO3+4N2 +9H2O,则发生氧化反应与发生还原反应的氮原子个数之比是
(
)
2HNO3+4N2 +9H2O,则发生氧化反应与发生还原反应的氮原子个数之比是
(
)
A.1:3 B.5:3 C.5:8 D.5:4
19.在标准状况下,mg气体A与ng气体B的分子数相同,下列叙述正确的是 ( )
A 气体A与 B的相对分子质量之比m:n
B 相同质量的气体A与 B的分子数之比n:m
C相同温度、压强下,气体A与 B的密度之比n:m
D 相同状况下,同体积气体A与 B的质量之比n:m
20. 实验室里需用480mL![]() 的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是
(
)
的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是
(
)
A. 称取7.68g硫酸铜,加入500mL水 B. 称取12.0g胆矾配成500mL溶液
C. 称取8.0g硫酸铜,加入500mL水 D. 称取12.5g胆矾配成500mL溶液
21.ALAl2(SO4)3溶液中含有BmolAl3+离子,则此盐溶液的物质的量浓度是 ( )
A.B/A mol/L B.2A/B mol/L C.B/2A mol/L D.A/2B mol/L
22.在标准状况下,将VL气体A(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度是
( )
第Ⅱ卷(非选择题,共31分)
二、填空题:(本大题共8小题 ,如有序号请用序号回答, 请把答案填在题中横线上)
23、(共3分)用给定的化学用语回答下列问题: ①过滤 ②结晶 ③丁达尔效应
④蒸馏 ⑤萃取 ⑥渗析
(1)鉴别胶体和溶液,可根据
(2)从硝酸钾溶液中提取硝酸钾,可采用
(3)分离二氧化锰和水的混合物,可利用
24.(共2分)下列反应中,属于氧化还原反应的是
①Na2O2 + 2HCl = 2NaCl + H2O2 ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Cl2 + H2O = HCl + HClO ④ ICl + H2O = HCl +HIO
25.(共4分)①写出下列反应的离子方程式:
A.氯化铁溶液中加入过量的氨水
B.醋酸和氢氧化钠溶液
②完成下列离子方程式:
C.( )+( )=CO2↑+H2O
D.BaCO3+( )=( )+CO2↑+H2O
26.(共2分)在标准状况下①6.72L
CH4 ②3.01×1023个HCl分子 ③13.6g H2S
④0.2mol NH3, 则这四种气体的氢原子个数从大到小的关系是
27.(共4分)某溶液由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子组成.取适量该溶液进行如下实验:
中的若干种离子组成.取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
③在②所得滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀.
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是__________________________
(2)原溶液中一定存在的离子是____________________________
28.(共5分)实验室配制500mL0.5mol/L的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转入500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度2cm~3cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀.
(1)操作步骤的正确顺序为(填序号) .
(2)本实验用到的主要仪器是 .
(3)若出现如下情况,所配溶液浓度将偏高还是偏低:
没有进行操作步骤④,会 ;
加蒸馏水时不慎超过了刻度,会
29.(共7分)已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑对此反应回答下列问题:
(1)此反应中BrF3是__________ 剂
(2)如有9gH2O被消耗时,反应中电子转移数为
(3)如有0.2mol H2O被氧化,则被H2O还原的BrF3的质量是
(保留二位小数)
30.(共4分) 某温度下,22%的硝酸钠溶液150毫升,加100克水稀释后浓度为14%,原溶液的物质的量浓度为________ _ (保留二位小数)。
化学参考答案
1、A 2、D 3、B 4、C 5、C 6、D 7、B 8、C 9、A 10、D 11、A
12、BC 13、C 14、D 15、B 16、D 17、C 18、B 19、AB 20、D21、C 22、B
23、(1)③(2)②(3)① (各1分)
24、②③ (2分)
25、A Fe3++3NH3·H2O=Fe(OH)3↓+3 NH4+
B CH3COOH+OH-=CH3COO-+H2O
C ![]() +2H+=CO2↑+H2O 或 HCO3-+H+=CO2↑+H2O
+2H+=CO2↑+H2O 或 HCO3-+H+=CO2↑+H2O
D BaCO3+2H+=Ba2+ + CO2↑+H2O (各1分)
26、①>③>④>② (2分)
27、(1)、![]() 、
、![]() 、
、![]()
(2)![]() 、
、![]() 、
、![]() (各2分)
(各2分)
28、(1)①②④③⑤ (2分)
(2)500mL容量瓶
(3)偏低
(4)偏低 (各1分)
29、(1)氧化剂还原剂 (2分)
(2)3.612x1022 (2分)
(3)18.27g (3分)
30、3.02mol/L (4分)