高一化学第一学期期中试卷
说明:本试卷分第Ⅰ卷和第Ⅱ卷。考试时间:100分钟 ,满分100分。请将第Ⅰ卷选择题的答案用2B铅笔涂到答题卡上,第Ⅱ卷的答案做在答卷纸上。交卷时只交答题卡和答卷纸,试卷自己保留。
第Ⅰ卷(选择题,共46分)
原子量:H—1 C—12 N—14 O—16 Na—23 P—31 S—32
Cl—35.5 K—39 Cu—64 Al—27 Mn-55 Br-80
一、单项选择题(本题包括8小题,每题只有一个选项符合题意,每小题2分,共16分)
1、 对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是( )




A. B C. D
2、为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是 ( )
A、Mg2+ B、Ca2+
C、Na+ D、Fe2+
3、电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞。雾属于下列分散系中的 ( )
A、胶体 B、悬浊液 C、乳浊液 D、溶液
4、在无色透明碱性溶液中,能共存的离子组是 ( )
A. Na+、 CO32- 、SO42- 、Fe2+ B. Ba2+、 NO3- 、Cl-、 Na+
C. K+、 SO42-、 HCO3-、Na+ D. MnO4- 、K+ 、SO42- 、Na+
5、现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②43%的乙醇溶液 ③氯化钠和单质溴的水溶液 ④淀粉胶体和葡萄糖溶液,分离以上各混合液的正确方法依次是()
A.分液、萃取、蒸馏、渗析 B.萃取、蒸馏、分液、渗析
C.分液、蒸馏、萃取、渗析 D.蒸馏、萃取、分液、过滤
6、下列变化中,加入氧化剂才能实现的是 ( )
![]()
![]() A.KCl AgCl B.H2O O2
A.KCl AgCl B.H2O O2
![]()
![]() C.CuSO4 Cu D.H2
H2O
C.CuSO4 Cu D.H2
H2O
7、关于1mol·1-1的Na2SO4溶液的叙述正确的是 ( )
A.溶液中含1molNa2SO4
B.Na+的浓度为1mol·1-1
C.配制时,将1molNa2SO4溶于1L水中
D.将322gNa2SO4·10H2O溶于少量水后再稀释成1000mL,即配制成相应浓度的溶液
8、等体积等物质的量浓度的H2SO4、NaOH溶液分别放在甲、乙两烧杯中,各加等质量的铝生成H2的体积比为5:6,则甲、乙两烧杯中反应情况可能分别是 ( )
A. 甲、乙中Al都过量 B. 甲中Al过量、乙中NaOH过量
C. 甲中H2SO4过量、乙中Al过量 D. 甲中H2SO4过量、乙中NaOH过量
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个或两个选项符合意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9、在一定条件下,RO3n—和氟气可发生如下反应:RO3n—+F2+2OH—=RO4—+2F—+H2O
从而可知在RO3n—中,元素R的化合价是 ( )
A、+4 B、+5
C、+6 D、+7
10、下列说法正确的是 ( )
A.摩尔质量就等于物质的式量 B.摩尔质量就是物质式量的6.02×1023倍
C.HNO3的摩尔质量是63g/mol D.硫酸和磷酸的摩尔质量相等
11、在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是 ( )
A.3:2 B.2:1 C.1:1 D.2:3
12、不能正确表示下列化学反应的离子方程式是 ( )
A.氢氧化钡溶液与硫酸的反应 Ba2++SO42—=== BaSO4↓
B.澄清的石灰水纯碱溶液反应 Ca2++CO32—=== CaCO3↓
C.铜片插入硝酸银溶液中 Cu+2Ag+===Cu2++2Ag
D.碳酸钙溶于稀盐酸中 CO32-+2H+===CO2↑+H2O
13、配制NaOH溶液时,下列操作情况会使结果偏高的是 ( )
A.NaOH固体溶解后,溶液未经冷却就立即移液至容量瓶中并定容
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容
14、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价) ( )
A、NaBH4既是氧化剂又是还原剂
B、被氧化的元素与被还原的元素质量比为1︰1
C、硼元素被氧化,氢元素被还原
D、.NaBH4是还原剂,H2O是氧化剂
15、有一在空气中暴露的KOH固体,经分析测知其中含水2.8%,K2CO37.2%,取1g该样品与5g36.5%的盐酸中,充分反应后,中和过量的盐酸又用去质量分数为37 %的KOH溶液5g,将所得的溶液蒸干,所得的固体的质量为 ( )
A、3.73g B、4.00g
C、4.50g D、7.45g
16、由Na2S、Na2SO3和Na2SO4三种物质组成的混合物,测得其中钠元素的质量分数为36.8%,则混合物中氧元素的质量分数是 ( )
A、 63.2% B、 44.8%
C、37.6% D、25.6%
17、有五瓶溶液分别是:①10ml 0.60 mol/L NaOH水溶液;②20ml 0.50 mol/L H2SO4水溶液;③30ml 0.40 mol/L HCl水溶液;④40ml 0.30mol/L CH3COOH水溶液;⑤50ml 0.20mol/L蔗糖水溶液。以下各瓶溶液所含离子、分子总数的大小顺序正确的是 ( )
A、①>②>③>④>⑤ B、②>①>③>④>⑤
C、②>③>④>①>⑤ D、⑤>④>③>②>①
18、下列反应是离子反应,但不是氧化还原反应的是 ( )
A.氯化钠溶液中滴入硝酸银溶液 B.金属钠在氯气中燃烧
C.铁片置于硫酸铜溶液中 D.金属钠放入水中生成氢氧化钠和氢气
第II卷(非选择题,共54分)
三、填空题(共35分)
19、(9分)⑴在标准状况下,物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2.含分子数最多的是(填序号,下同)__ __ __,含原子数最少的是___ ____,质量最大的是____ ___,体积最小的是_ ______。
⑵写出过氧化钠和水反应的化学方程式 ______
在此反应中,氧化剂是 ,还原剂是 ,每有1mol过氧化钠反应,则转移电子个数为_____________。
20、(3分)已知高锰酸钾和氢溴酸发生反应:2KMnO4+16HBr=2KBr+2MnBr2+5Br2↑+8H2O
(1)反应中的还原剂_________________;
(2)若消耗15.8 g氧化剂,则被氧化的还原剂的物质的量是__________mol。
21、(9分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下装置图:
![]() 请回答下列问题:
请回答下列问题:
⑴写出Na与H2O反应的离子方程式 ;
⑵在点燃H2之前必须先进行 ,方法是
;
⑶实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却
失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的
用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危
险的原因是 。
⑷实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。
![]()
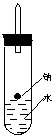
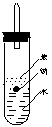
原实验 改进后实验
在改进后的实验中H2的生成速率减慢。原因是
。
22、(7分)实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。B.把制得的溶液小心地转移至容量瓶中。C.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切。D.用少量蒸馏水洗烧杯和玻璃棒2—3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。E.将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
 (2)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的仪器是
、
、
。
(2)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的仪器是
、
、
。
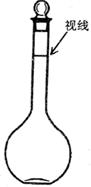
(3)下列情况会使所配溶液浓度偏高的是(填序号)
a.某同学观察液面的情况如图所示
b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶用前内壁沾有水珠
23、(7分)有一包粉末,其中可能含有Na2CO3、NaCl、K2SO4、FeCl3、BaCl2、K2CO3和Na2SO4,现按下列步骤进行实验:
(1)将该粉末溶于水得无色溶液和白色沉淀
(2)在滤出的沉淀中加入足量稀HNO3后,有部分沉淀溶解,同时产生无色气体
(3)取滤液做焰色反应,火焰呈黄色,隔着蓝色钴玻璃观察,未见紫色火焰。
(提示:钠的焰色反应火焰呈黄色,钾的焰色反应隔着蓝色钴玻璃观察,有紫色火焰)
由上述实验现象推断:混合物中一定含有 ,一定不含有 ,不能肯定是否含有 。
24、(6分)对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、洗气、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
①实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
②除去H2中的CO2,可用 的方法除去。
③除去乙醇中溶解的微量食盐可采用 的方法。
④粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再 ;然后将溶液调成中性并
就可以得到较为纯净的氯化钠。
⑤除去氧化钙中的碳酸钙可用 的方法。
四、计算题(共13分)
25、(4分)将浓度为a%的NaOH溶液蒸发掉mg水后,变成2a%的NaOH不饱和溶液VmL。求所得NaOH溶液的物质的量浓度。
26、(9分)有一表面被氧化成氧化钠的金属钠样品5.22g,投入到100g水中,产生气体2.24L(标况)。
求:1、此样品中单质钠的物质的量?
2、所得溶液溶质的质量分数?
高一化学第一学期期中试卷
| 题 | |
| 名 姓 | 答 |
| 准 | |
| 号 学 | 不 |
| 内 线 | |
| 级 班 | 封 |
| 密 | |
| 校 学 | |
高一化学期中试卷答卷纸
19、(9分)
(1)含分子数最多的是(填序号,下同)__ __ __, 含原子数最少的是___ ____,质量最大的是____ ___,体积最小的是_ ______。
⑵写出过氧化钠和水反应的化学方程式 _____
氧化剂是 ,还原剂是 ,转移电子个数为_ ____________。
20、(3分)
(1)反应中的还原剂_________________;
(2)若消耗15.8 g氧化剂,则被氧化的还原剂的物质的量是__________mol。
21、(9分)
⑴写出Na与H2O反应的离子方程式 ;
⑵在点燃H2之前必须先进行 ,方法是
;
⑶你认为产生危险的原因是 。⑷原因是 。
22、(7分)
(1)操作步骤的正确顺序为(填序号) 。
(2)还缺少的仪器是 、 、 。
(3)使所配溶液浓度偏高的是(填序号)
23、(7分)
混合物中一定含有 ,一定不含有 ,不能肯定是否含有 。
24、(6分)
① ② ③
④ ; ⑤
25、(4分)将浓度为a%的NaOH溶液蒸发掉mg水后,变成2a%的NaOH不饱和溶液VmL。求所得NaOH溶液的物质的量浓度。
26、(7分)有一表面被氧化成氧化钠的金属钠样品5.22g,投入到100g水中,产生气体2.24L(标况)。
求:1、此样品中单质钠的物质的量?
2、所得溶液溶质的质量分数?
高一化学期中试题参考答案及评分建议
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意。)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | C | A | B | C | D | D | B |
二、选择题(本题包括10小题,每小题3分,共30分。漏选得1分,错选0分。)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | CD | D | AD | AC | BD | A | C | D | A |
19(共9分)(1)①;④;②;③。(每空1分,共4分)(2)2Na2O2+2H2O==4NaOH+O2(2分),Na2O2(1分),Na2O2(1分),NA(1分)(1mol不给分)
20、(共3分) ⑴HBr (1分) ⑵ 0.5(2分)
21、(共9分)⑴2Na+2H2O=2NaOH+H2↑(2分)
⑵验纯(1分),用向下排气法收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“扑”声,则表明H2纯净。(2分)
⑶较多的钠与水反应放出大量的热,使试管内H2与O2的混和气点燃而爆炸。(2分)
⑷钠比水轻,比苯重,落在苯水交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,就可减慢Na与H2O反应速度。(2分)
22、(共7分)(1)ABDCE(2分)(2)量筒、胶头滴管、500 mL容量瓶(3)a、d(2分)
23、(共7分)BaCl2,Na2CO3,Na2SO4;CuCl2,K2SO4,K2CO3;NaCl (各1分)
24、(共6分)①过滤 ②洗气 ③蒸馏 ④过滤 蒸发 ⑤加热分解
25、(共4分)原溶液为2m g(1分)
含NaOH:![]() (1分)
(1分)
![]() (2分)
(2分)
26、(共9分)
(1)n(H2)=0.1 mol (1分),由2Na+2H2O=== 2 Na+ +2 OH-+H2↑(1分)
得n(Na)=0.2 mol(2分)
(2) m(Na)=4.6 g,所得n(NaOH)= 0.2 mol (1分)
m(Na2O)=0.62 g,所得n(NaOH)= 0.02 mol (1分)
m(NaOH)=0.22 mol×40 g·mol-1 =8.8 g (1分)
(NaOH) =![]() (2分)
(2分)