高一化学第一学期期末检测卷
说明: (1)请将答题内容做在答题卷上,做在试题卷上无效。
(2)本卷所用相对原子质量:H=1 O=16 C=12 N=14 Cl=35.5 Na=23 Mg=24 Al=27 Ca=40 Ba=137 Ag=108
(3)考试时间:90分钟; 满分100分。
一.选择题:(本题每小题只有一个合适选项,每小题2分共48分)
1.最近中科院近代物理所有关专家在世界上首先发现了镤元素的一种新同位素![]() ,它的中子数为
,它的中子数为
A.330 B.91 C.239 D.148
2.下列四种基本反应类型中,一定属于氧化还原反应的是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
3.下列转化中,不符合化学变化科学规律的是
A.石灰石(CaCO3)转化成生石灰(CaO)
B.将无机物氰酸铵(NH4CNO)转化成有机物尿素CO(NH2)2
C.水(H2O)变成汽油(主要成份之一:C8H18)
D.在一定条件下CO2和H2O能转化成葡萄糖(C6H12O)
4.下列表格中各项分类都正确的一组是
|
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 苏 打 | 纯净空气 | KNO3 | 蔗糖 |
| B | 碘 酒 | 海 水 | 食盐水 | Fe |
| C | 纯净空气 | 铝 合 金 | CO2 | Cl2 |
| D | 盐 酸 | CuSO4·5H2O | Na2SO4 | 酒精 |
5.下列说法正确的是(NA为阿伏加德罗常数)
A.28g氮气含有的原子数为NA
B.4g金属钙变成钙离子时失去的电子数为0.1NA
C.1molO2分子的质量等于1mol氧原子的质量
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
 6.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是
6.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是
A.人体不能缺碘,需要正常补碘。“加碘食盐”中的“碘”是指碘单质
B.该食盐商品是以海盐为原料,经人加工后的产品,是盐类的纯净物
C.1kg此食盐中含碘酸钾(35±15)mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
7.欲将NaCl、沙子(主要成份SiO2)、I2晶体的混合物分离,最科学的操作顺序是
A.溶解、过滤、加热(升华)、蒸发(结晶)
B.加热(升华)、溶解、过滤、蒸发(结晶)
C.加热(升华)、溶解、蒸馏、结晶
D.溶解、结晶、过滤、升华
8.用激光笔照射下列分散系,在侧面能看到一条光亮通路的是
A.CuSO4溶液 B.稀H2SO4
C.Fe(OH)3胶体 D.NaCl溶液
9.二氧化氯(ClO2)是一种具有和氯气相似的刺激性气味的气体,沸点为11℃,常温下在水中的溶解度为2.9g/L。它是一种更安全的高效消毒剂,它的氧化能力是氯气的2.5倍,现在已普遍用它替代氯气对自来水进行消毒。下列关于二氧化氯说法错误的是
A.通入二氧化氯气体不能使KI-淀粉溶液变色
B.二氧化氯的摩尔质量为67.5 g ·molˉ1
C.二氧化氯具有消毒性能是因为它具有很强的氧化性
D.二氧化氯中氯元素的化合价为+4价
10.某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列处理措施合理的是
A.人员就近向地下商场转移
B.液氯罐中的液氯泄漏时,可将其移入开挖的水塘中,并在水塘中加入生石灰
C.及时戴上用浓烧碱溶液湿润过的口罩
D.及时用毛巾包裹活性炭捂住口鼻向低处转移
11.除去镁粉中混有的少量铝粉,可选用的试剂是
A.盐酸 B.硫酸 C.氨水 D.氢氧化钾溶液
12.下列物质一般情况下不能用单质直接化合而制得的是
A.HCl B.NaCl C.FeCl2 D.CuCl2
13.金属钠分别和下列各物质的水溶液反应时既有气体产生,又有沉淀生成的是
A.(NH4)2SO4 B.NaHCO3 C.BaCl2 D.CuSO4
14.为除去实验室制得的CO2气体中的少量HCl气体,最好将混合气体通过
A.烧碱溶液 B.饱和碳酸氢钠溶液
C.碳酸钠溶液 D.浓硫酸
15.下列说法不正确的是
A.通过电解熔融的无水MgCl2可以制得金属镁
B.镁条在空气中燃烧所得的固体物质是混合物
C.氧化镁是优质的耐火材料
D.金属镁质地柔软,不适宜制作高强度的合金材料
16.某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是
A.Al3+、NO3ˉ、K+、SO42ˉ B.Ca2+、H+、HCO3ˉ、Na+
C.OHˉ、CO32+、Cu2+、SO42ˉ D.Fe3+、Mg2+、NO3ˉ、Clˉ
17.下列离子方程式中正确的是
A.铜片置于FeCl3溶液中:Cu + Fe3+ = Fe2+ + Cu2+
B.大理石与盐酸反应:CO32ˉ+ 2 H+ = CO2↑ + H2O
C.AlCl3溶液中滴入过量的氨水:Al3+ + 3 OHˉ= Al(OH)3↓
D.氢氧化铝和氢氧化钠溶液反应:Al(OH)3 + OHˉ= AlO2ˉ+ 2 H2O
18.科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中错误的是
A.自然界中硅元素的储量丰富
B.自然界中存在大量的单质硅
C.高纯度的硅被用作计算机芯片
D.可用H2在高温下还原SiCl4的方法得到高纯硅
19.“雪耳”制作过程如下:将银耳堆放在密闭状况良好的塑料棚内,在棚的一端支一口小锅,锅内放些硫磺,加热使硫磺熔化并燃烧,两天左右,雪耳就制成了。雪耳炖而不烂,看上去也很漂亮,但对人体有害。制作雪耳利用的是
A.硫的氧化性 B.二氧化硫的还原性
C.硫的漂白性 D.二氧化硫的漂白性
20.目前,我国长三角地区大气污染的主要有害物质是(其中NOx为氮氧化物)
A.NOx、CO2、雾 B.CO2、Cl2、酸雨
C.SO2、NOx、烟尘 D.SO2、CH4、沙尘暴
21.某同学弄清氨的喷泉实验原理后有了一个创新的设计:如果改换一下烧瓶内的气体和胶头滴管.烧杯中的液体,也能做成喷泉实验。那么下列各组中的气体和液体不符合该学生设计的一组是:
A.SO2和NaOH溶液 B.O2和水
C.CO2和NaOH溶液 D.Cl2和NaOH溶液
22.能够一次性鉴别BaCl2、NaCl、Na2CO3三种物质的一种试剂是
A.AgNO3 B.稀H2SO4 C.稀HCl D.稀HNO3
23.要证明某溶液中不含Fe3+ 而可能含Fe2+ ,进行如下实验操作时的最佳顺序为:①加入足量氯水;②加入足量的KMnO4溶液;③加入少量的KSCN溶液;
A.①③ B. ②③ C.③① D. ①②③
24.Al分别与足量的稀盐酸和NaOH溶液反应,当两个反应放出的气体体积在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为
A.2∶1 B.1∶2 C.3∶1 D.1∶3
二.填空题(每空2分,共28分)
25.新制氯水中含有以下微粒:Cl2、H2O、HClO、H+、Clˉ、ClOˉ和极少量的OHˉ填写氯水在与下列物质反应时,氯水中起主要作用那种微粒的化学式:
(1)氯水与硝酸银反应生成沉淀 ▲ ;
(2)向氯水中滴入紫色石蕊试液显红色 ▲ 后溶液颜色褪去 ▲ ;
![]() 26.实验室制取氯气的化学方程式如下: 4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
26.实验室制取氯气的化学方程式如下: 4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
请回答下列问题:
(1)该反应中还原剂的化学式是 ▲ ;被还原元素的元素符号是 ▲ ;
(2)表示出该反应中电子的转移方向和数目 ▲ ;
(3)当电子转移的数目为3.01×1023个时被氧化的还原剂的物质的量为 ▲ mol。
27.有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层(第三层)电子数比L层(第二层)少1个电子;C元素的原子得到2个电子.D元素的原子失去1个电子、所得到的微粒都具有与氖原子相同的电子层结构。回答列问题:
(1)上述四种元素中C的名称是 ▲ ;
(2)画出B原子的结构示意图 ▲ ;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式 ▲ ;
A的氢氧化物和D的氢氧化物反应的离子方程式 ▲ 。
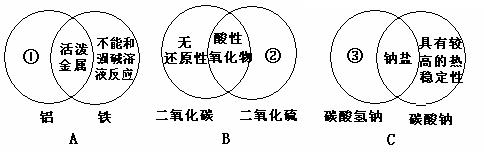 28.下图是一种用于显示事物异同点的信息处理方法。例A图中的两个圆分别代表铝和铁
28.下图是一种用于显示事物异同点的信息处理方法。例A图中的两个圆分别代表铝和铁
的有关信息,两圆重叠的区域表示铝和铁的共同特点(相似点),重叠区域以外的部分表示它们独有的特征(不同点)。请你在下面横线上用化学方程式来表示与图中①②③区域对应的化学性质上的异同点(每处只要求写一个)。
① ▲ ;② ▲ ;③ ▲ 。
三.实验与探究题:(本题共14分)
29.实验室要配置0.50 mol·Lˉ1 Na2CO3溶液250mL:
(1)配制上述溶液,需要无水Na2CO3 ▲ g。
(2)配制上述溶液需要容量瓶和玻璃棒、胶头滴管、烧杯等仪器,除此之外还必需要有的仪器是 ▲ ;
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(选填“偏高”.“偏低”或“不变”)
①没有将洗涤烧杯和玻璃棒后的洗涤液转移到容量瓶中就直接进行定容 ▲ ;
②定容时俯视容量瓶的刻度线 ▲ ;
③加蒸馏水时不小心液面超过了刻度线,又取出一些溶液使液面恰好到刻度线 ▲ ;
30.工业上制胆矾(CuSO4·5H2O)是用废铜屑在空气中经充分灼烧,并在加热情况下与稀硫酸反应,趁热过滤.冷却、结晶,便得到工业胆矾。从环保和节约的角度考虑,不采用铜和浓硫酸反应制胆矾的原因是:(1) ▲ ;(2) ▲ ;
四.计算题(每小题5分,共10分)
31.将19 g MgCl2溶于水配成500ml溶液:
(1)上述MgCl2溶液的物质的量浓度为多少?
(2)取出上述溶液50ml加入0.5 mol·Lˉ1的AgNO3溶液使其中的Clˉ恰好全部沉淀,则需要AgNO3溶液的体积为多少ml?
32.为测定镁铝合金中各金属的含量,取一定量的镁铝合金完全溶于足量的6 mol·Lˉ1盐酸,在标准状况下收集到8.96升H2,在所得溶液中加入过量的氢氧化钠溶液充分反应后过滤,生成的沉淀经洗涤.干燥.称重质量为5.8 g。求
(1)收集到的氢气的物质的量为多少?
(2)原合金中镁、铝的质量分别是多少g?
高一化学答题卷 ( 2007 / 01 )
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
一.选择题(每小题均只有一个合适选项,每小题2分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
二.填空题(每空2分,共28分)
25.(1) ;
(2) ;
;
26.(1) ; 元素符号是 ;
(2) ;
(3) 物质的量为 mol。
27. (1) C的名称是 ;(2) B原子的结构示意图 ;
(3) ;
。
28.
① ;
② ;
③ 。
三.实验与探究题:(本题共14分)
29.(1) g。
(2) 仪器是 ;
(3) ① ;
② ;
③ ;
30. (1) ;
(2) ;
四.计算题(每小题5分,共10分)
31.
32.
高一化学卷 答案
一.选择题(每小题均只有一个合适选项,每小题2分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | C | C | A | D | D | B | C | A | B | D | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 | D | B | D | A | D | B | D | C | B | B | C | C |
二.填空题(每空2分,共28分)
25.(1)Clˉ;(2)H+;HClO;
26.(1)HCl;Mn;(2)表示出该反应中电子的转移方向和数目略;(3)0.5mol。
27.(1)氧元素;(2)氯原子的结构示意图;
(3)2Na+O2=点燃=Na2O2; Al(OH)3+OHˉ=AlO2ˉ+2H2O。
28.①2Al+2NaOH+ 2H2O=2NaAlO2+3H2↑。
②2SO2+O2=催化剂,加热=2SO3;
③2NaHCO3=加热=Na2CO3+CO2↑+H2O。
三.实验与探究题:(本题共14分)
29.(1)13.25g。 (2)托盘天平;
(3)①偏低;②偏高;③偏低;
30.(1)因为铜与浓硫酸反应会产生二氧化硫污染空气;
(2)若用铜与浓硫酸反应会消耗更多的硫酸;
四.计算题(每小题5分,共10分)
31.(1)0.4 mol·Lˉ1(3分);(2)80ml(2分)
32.(1)0.4 mol(3分);(2)镁2.4 g;铝5.4 g;(2分)