第一章 从实验学化学
一. 选择题(每小题只有一个选项题意。)
1.下列气体所含原子数最多的是A
A.10g 氨 B.14g 氮气 C.4g 氦气 D.24g 臭氧
2、(2005 MCEG)将钠、镁、铝0.3mol分别放入100mL1mol·![]() 的盐酸中,同温同压下产生的气体体积比是
的盐酸中,同温同压下产生的气体体积比是
A、1︰2︰3 B、6︰3︰2 C、3︰1︰1 D、1︰1︰1
3、 实验室中,对下列事故或药品的处理正确的是( )
A. 有大量的氯气泄漏时, 用肥皂水浸湿软布蒙面,并快速离开现场
B. 金属钠着火是有泡沫灭火器灭火
C. 少量浓硫酸沾到皮肤上,立即用氢氧化钠溶液冲洗
D. 含硫酸的废液倒入水槽中,用水冲入下水道
4.下列离子方程式书写正确的是
A.少量的金属钠投入水中: Na+H2O===Na++OH-+H2↑
B.铝片投入稀盐酸中:Al+6H+===Al3++3H2↑
C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42-===BaSO4↓
D.氧化铝溶于烧碱溶液:Al2O3+2OH-===2AlO2-+H2O
5. (2003 MCELZ)在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A. 原子数 B. 密度 C. 质量 D. 质子数
二、选择题(每小题有一个或两个选项符合题意。)
6、(2003 MCEG) 设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的电子数为NA
C. 常温常压下,48g O3含有的氧原子数为3NA
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
7、下列溶液中,跟100mL 0.5mol/L KCl溶液所含的Cl-物质的量浓度相同的是( )
A.100mL 0.5mol/L MgCl2溶液 B.200mL 0.25mol/L CaCl2溶液
C.50 mL 1mol/L NaCl溶液 D.25 mL 0.5mol/L HCl溶液
8.下列除去杂质的方法正确的是
A 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
9、欲配制100ml 1.0 mol/L CuSO4溶液,正确的方法是
① 将16 g CuSO4 溶于100 mL水中
② 将25g CuSO4·5H2O溶于少量水中,再用水稀释至100 mL
③ 将20 mL 5.0 mol/L CuSO4溶液用水稀释至100 mL
A.①② B.①③ C.②③ D.①②③
10.将4克NaOH溶解在100mLH2O中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度是( )
A.2mol/L B.0.1mol/L C.0.01mol/L D.10mol/L
11、 关于浓度2mol·L-1的MgCl2溶液,下列叙述正确的是( )
A.1L水中溶解了2molMgCl2固体
B.1L溶液中含有1.204×1024 Cl-
C.取0.5L该溶液,则Mg2+ 的物质的量浓度为1mol·L-1
D.0.5L溶液中, Cl-的物质的量为2mol
三、填空题
12. 标准状况下,1mol O2和1mol H2的混合气体的体积是________L,含有氧原子的物质的量是 ,该条件下的O2的摩尔质量为___________,混合气体的质量为 。
13. 19.2g Cu与足量的稀硝酸反应产生气体的体积 (标况下),消耗硝酸的物质的量为 ,被还原的硝酸的物质的量为 。
14. 已知2KMnO4+16HCl==2KCl+2MnCl2+5 Cl2↑+8H2O,该反应中,氧化剂是 ,若生成Cl2 11.2L(标准状况),则转移电子的物质的量为 mol。
15. 取1mol/LAlCl3溶液60mL,加入一定量的NaOH溶液,结果得到2.34g的Al(OH)3沉淀。加入的溶液中NaOH的物质的量可能为 mol或 mol。
16、有一瓶无色澄清溶液中含有Cl-、Cu2+、CO32-、SO42-、Na+、NH4+、Ba2+、Mg2+八种离子中的某几种,经实验:
①取少量溶液加入NaOH溶液产生白色沉淀。
②将①所得溶液加热放出使湿润的红色石蕊试纸变蓝的气体。
③取少量原溶液加BaCl2溶液产生白色沉淀。
试分析
(1)溶液中一定含有______________________________,
一定不含有__________________________________,
可能含有____________________________________。
(2)为检验可能含有的阳离子,可进行的实验操作是____________________,
如若存在则现象是___________________________。
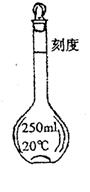 四、实验题
四、实验题
17.欲配制250mL 0.1mol/L NaOH溶液,回答下列问题:
(1)右图中仪器的名称是 ,使用此仪器前
要检查它是否 ;
(2)转移溶液时,应将已冷却的NaoH溶液沿
注入右图所示的仪器中;
(3)若称量前NaOH已部分潮解,则配制的溶液浓
度则配制的溶液浓 (填“偏大”或“偏小“)
寒假作业:
第二章 化学物质及其变化
一. 选择题(每小题只有一个选项题意。)
1. 关于反应3Cu +8HNO3 (稀) = 3Cu(NO3)2+2NO↑+4H2O,下列说法正确的是
A.Cu 化合价降低,是还原剂 B. Cu 化合价升高,是氧化剂
C.HNO3化合价降低,是还原剂 D. HNO3化合价降低,是氧化剂
2.在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,还原剂与氧化剂的物质的量之比为
A.1 :1 B.2 :1 C.1 :2 D.3 :2
3. 从硫元素的化合价态上判断,下列物质中的硫元素不能表现还原性的是 ( )
A.Na2S B. S C. SO2 D. H2SO4
4、(1997 TCE) R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO3-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
A. 1 B. 2 C. 3 D. 4
5、有三种不同浓度的稀H2SO4,体积比为3︰2︰1,它们分别与物质的量相等的K2CO3、NaHCO3、Al刚好完全反应(均有气体物质生成),则上述三种硫酸物质的量浓度之比依次为( )
A 1︰1︰1 B 6︰2︰3 C 4︰3︰18 D 2︰1︰3
6、由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( )
(A)锌 (B)铁 (C)铝 (D)镁
7.既可以在强酸性条件下大量共存又能在强碱性条件下大量共存的离子组是
A Al3+ Na+ NO3- Cl- B K+ Na+ Cl- NO3-
C K+ Na+ Cl- AlO2- D K+ NH4+ SO42- NO3-
二、选择题(每小题有一个或两个选项符合题意。)
8.下列说法中,正确的是:
A.O2的摩尔质量与NA个O2分子的质量在数值上相等
B.0.1 mol/L CaCl2 溶液中,含有2NA 个Cl—
C.C60 的摩尔质量是720g
D.标准状况下,1mol H2O 的质量是18 g
9.下列反应中,水既不是还原剂也不是氧化剂的氧化还原反应是 ( )
A.钠与水反应 B.过氧化钠与水反应
C.铁与水蒸气反应 D.二氧化氮与水反应
10、(1997 MCE)下列叙述中,正确的是 ( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变成游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
11.下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应 HCO![]() + Ca2+ + OH—
= CaCO3↓ + H2O
+ Ca2+ + OH—
= CaCO3↓ + H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热OH— + NH![]() △ H2O + NH3↑
△ H2O + NH3↑
C.氢氧化镁与稀硫酸反应 H+ + OH— = H2O
D.单质铜与稀硝酸反应 Cu + 2 H++ 2NO![]() = Cu2+ + 2NO↑+H2O
= Cu2+ + 2NO↑+H2O
12.必须加入氧化剂才能实现的反应是
A.KMnO4 → O2 B.Fe3+ → Fe2+ C.S → SO2 D.CO32- → CO2
13. 下列反应既属于离子反应,又属于氧化还原反应的是
A.Zn与CuSO4 溶液的反应 B.实验室制氨气
C.NaOH溶液与盐酸中和 D.二氧化锰与浓盐酸加热制氯气
14.在酸性溶液中能大量共存而且为无色透明的溶液是 ( )
A.NH4+、AlO2-、SO42-、SiO32- B.K+、Na+、NO3-、SO32-
C.K+、Cl-、NH4+、NO3- D.Na+、K+、Fe2+、NO3-
15.在pH=l含![]() 离子的溶液中,还能大量存在的离子是
离子的溶液中,还能大量存在的离子是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
16、(1997 MCE)下列说法正确的是(NA表示阿伏加德罗常数)
A. 在常温常压下,11.2LN2含有的分子数为0.5NA
B. 在常温常压下,1mol Ne含有的原子数为NA
C. 在71g Cl2所含有原子数为2NA
D、在同温同压时,相同体积的任何气体单质所含有的原子数相同
三、填空题
17. 在4个脱落标签的试剂瓶中,分别盛有盐酸、AgNO3溶液、BaCl2溶液、Na2CO3溶液。为了鉴别各瓶中的试剂,将他们分别编号A、B、C、D并两两混合,其实验现象为:A+B产生无色气体;B+C产生白色沉淀;A+D产生白色沉淀;B+D无明显变化。由此推断:
试剂A为 ,试剂D为 。
A+B反应的离子方程式为 ,
B+C反应的离子方程式为 。
18、当设NA为阿伏加德罗常数时,请判断下列叙述是否正确。
(1) 18g H2O所含电子数目为10NA
(2) 16g氧气和16g臭氧含有的原子数目都是NA
(3) 标准状况下,11.2L四氯化碳所含分子数为0.5NA
(4) 2g氦气所含原子数为NA
(5) 标准状况下,1L水所含分子数为![]() NA
NA
(6) 2.7g金属铝变为铝离子时失去的电子数为0.3NA
(7) 1mol甲烷中含有10NA个电子
(8) 0.1NA个硫酸分子与9.8g磷酸含有相同的质子数
(9) 1mol·L-1氯化钡溶液中Cl-数目是0.2NA
(10) 常温常压下,1mol水含有NA个H+和NA个OH-
参考答案: 第一章 从实验学化学
一、选择题1.A 2.C 3. A 4.D 5.A
二、选择题6.BC 7.BD 8. C 9.C 10.B 11.B
三、填空题
12、44.8 2 mol 32g/mol 34g
13、4.48L 0.8 mol 0.2mol
14、KMnO4 1
15、0.09 mol 0.21mol
16、(1)