高一化学上学期质量抽测试卷
高 一 化 学
| 题 号 | 一、二 | 总 分 | ||||||||
| 1至20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | ||
| 得 分 | ||||||||||
请将一、二选择题答案填入下面“答案栏”里
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 Ba-137
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.如果你家里的食用花生油混有了水,你将采用下列何种最佳方法分离它们
 A.过滤 B.蒸馏 C.分液 D.萃取
A.过滤 B.蒸馏 C.分液 D.萃取
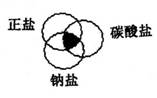
2.符合右图中阴影部分的物质是
A.Na2CO3 B.Cu2(OH)2CO3
C.NaCl D.NaHCO3
3.根据中央电视台报道,近年来,我国一些沿江城市多次 出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系
A.溶液 B.悬浊液 C.乳浊液 D.胶体
4.制碱水棕所用的食用碱与著名化学家侯德榜有密切关系,其主要成分是
A.烧碱 B.纯碱 C.芒硝 D.食盐
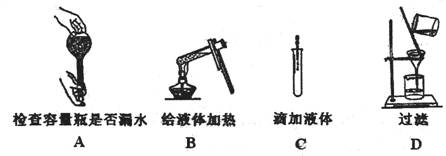
5.如下图所示,下列实验操作与方法正确的是
6.起固定氮作用的化学反应是
A.N2与H2在一定条件下反应生成NH3 B.NO遇O2转化为NO2
C.硝酸工厂用NH3氧化制NO D.由NH3制NH4HCO3和(NH4)2SO4
7.自来水是用适量氯气杀菌消毒过的。不法商贩常用自来水冒充纯净水谋取暴利,可用化学试剂鉴别真伪,该试剂可以是
A.酚酞试液 B.氯化钡溶液 C.氢氧化钠溶液 D.硝酸银溶液
8.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗铅笔芯的质量约为lmg。那么一个铅笔字含有的碳原子数约为
A.2.5×1019个 B.2.5×1022个 C.5×1019个 D.5×1022个
9.利用新技术能将不锈钢加工成柔软的金属丝,它可以和棉纤维一起编织成为防辐射的劳防服装,这是利用了金属的
A.耐腐蚀性 B.还原牲 C.热传导性 D.延展性
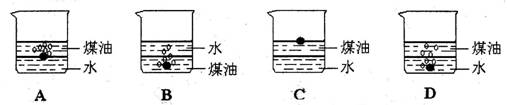
10.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一绿豆大小的金属钠,可能观察到的现象符合下图中的
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.用NA表示阿伏加德罗数的值,下列说法正确的是
A.2.4g镁与足量的盐酸反应时失去0.1NA个电子
B.含有0.1NA个CO32-的NaCO3固体的质量为10.6g
C.0.5mol纯硫酸所含有的氧原子数与NA个CO2分子中所含有的氧原子数相等
D.常温常压下,11.2L氧气所含的原子数为NA
12.溴(Br)与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性更强,下面是根据氯的性质对溴的性质的预测,其中错误的是
A.溴单质溶于水时,部分与H2O反应生成HBrO和HBr
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴蒸气与氢气在加热下反应生成HBr
13.实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为lmol·L-1。下面四个选项中能达到此目的的是
A.NH4+、Na+、NO3-、Cl- B.Cu2+、K+、SO42—、NO3—
C.H+、K+、HCO3-、Cl— D.Mg2+、Na+、Cl—、SO42—
14.过氧化氢由于在反应后生成氧气或水,被称为“绿色试剂”。下列反应中过氧化氢只表现还原性的是
A.2KMnO4+5H2O2+3H2SO4=K2S+2MnSO4+5O2↑+8H2O
B.H2O2+Cl2=2HCl+O2↑
C.2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D.H2O2+H2S=2H2O+S↓
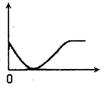 15.下列实验过程中产生的现象与右边座标图形相符合的是
15.下列实验过程中产生的现象与右边座标图形相符合的是
A.稀盐酸滴加到一定量NaHCO3,溶液中(横坐标是稀盐酸的体积,纵坐标为气体体积)
B.NaOH溶液滴入Ba(HCO3)2溶液中(横坐标是NaOH溶液的体积,纵坐标为沉淀质量)
C.稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
D.稀硫滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
16.下列反应的离子方程式书写正确的是
A.Ba(OH)2溶液中加入稀硫酸:Ba2++SO42-=BaSO4↓
B.金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
C.大理石和稀盐酸反应:CaCO3+2H+=CO2↑+H2O
D.FeCl3溶液中加入Fe粉:2Fe3十+Fe=3Fe2+
17.化学上许多重大发现是来自实验中的精确量度和对许多数据的总结。在化学实验室进行下列操作时,可鲳测出的数据是
A.用托盘天平称2.10gNaCl
B.用量简取21.35mL盐酸
C.用10.4gNaOH固体和容量瓶配制1.0mol·L-1的NaOH溶液260mL
D.用0.12mol·L-1盐酸滴定NaOH溶液,消耗盐酸19.32mL
18.某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[A12(OH)nClm·yH2O]x,式中m等于
A.3一n B.6一n C.6+n D.3+n
19.下列说法正确的是
A.SiO2是一种立体网状结构的晶体,熔点高、硬度大
B.CO2通入水玻璃中可以得到硅酸溶胶
C.用玻璃试剂瓶瓶来盛放氢氟酸
D.用磨口玻璃塞的试瓶瓶来盛放KOH溶液
20.向下列各物质的水溶液中滴加稀硫酸或MgCl2溶液时,均有白色沉淀生成的是
A.BaCl2 B.Na2CO3 C.Ba(OH)2 D.KOH
三、(本题包括3小题,共28分)
21.(10分)写出除去下列物质中所混有的少量杂质的方法及有关的反应方程式。
⑴铜粉中混有少量铝粉
。
⑵FeCl3潜藏中混有少量FeCl2
。
⑶Na2CO3固体中混有少量NaHCO3
。
22.(6分)有甲、乙两位同学根据所学化学知识,设由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuSO4②由Cu→CuO→CuSO4。试回答:
⑴这两种方案,你认为哪一种方案比较合理? (答编号),理由是:
。
⑵实验室采用方案①铜与浓硫酸加热直接反应制取硫酸铜时,会有气体产生,若将产生的气体通人盛有品红溶液的试管中,看到韵现象是 ,
原因是 。若通入盛有石蕊试液的试管中,看到的现象是 。
23.(12分)已知:溴的水溶液呈黄色,溴的四氯化碳溶液呈橙红色。在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
⑴甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是 (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是 。
⑵现提供如下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
实验证明乙同学的推断是正确的,请用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
⑶根据上述实验推测,若在稀溴化亚铁溶液中通人氯气,首先被氧化的离子是
,写出在稀溴化亚铁溶液中通人足量氯气时的离子方程式:
。
四、(本题包括3小题,共30分)
24.(12分)在8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O反应中,
⑴ 元素被还原, 是还原剂。
⑵ 是氧化产物, 是还原产物。
⑶在参加反应的硝酸中,起氧化剂(被还原)作用的HNO3与起酸性作用的HNO3的质量比为 。
⑷在上述化学方程式中用双线桥标明电子转移的方向和数目。
25.(8分)解释下列事实:
⑴饲养金鱼用的自来水须经日光曝晒或放置过夜后方能使用,其原因是
。
⑵常温下可用铁、铝制容器来盛装浓硫酸或浓硝酸,其原因是
。
⑶氨水呈弱碱性,其原因是(用离子方程式表示):
。
26.(10分)A、B、C、D分别是Na2SO4、NaOH、HNO3、Ba(NO3)2四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。试确定A、B、C、D、X各代表何种溶液。
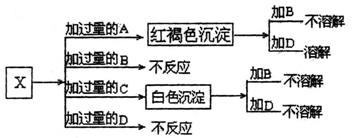
A ;B ;C ;D ;X 。
五、(本题包括2小题,共22分)
27.(8分)含氮废水进人水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+6H2O=3N2↑+4Al(OH)3+6AlO2—
⑴现在要除去含氮元素0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝 g。
⑵有人认为金属镁比铝能更快消除氮的污染,反应原理和金属铝相同,其反应的离子方程式是:2NO3-+5Mg+6H2O=N2↑+5Mg(OH)2+2OH-。
已知金属镁是从海水中提取的MgCl2通过电解[MgCl2(熔融)![]()
![]() Mg+Cl2]。若要除去含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
Mg+Cl2]。若要除去含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
28.(14分)取l00mL的Na2CO3和Na2SO4混合溶iyw 加入适量Ba(OH)2溶液100mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀,再用过重稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。
⑴写出上述有关反应的离子方程式
。
(2)原混合溶液中Na2SO4的物质的量浓度为 mol·L-1。
⑶产生的气体在标准状况下的体积为 L。
⑷过滤出沉淀后,所得滤液的物质的量浓度为 mol·L-1,(反应前后溶液体积变化忽略不计)。
高 一 化 学
答 案
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | D | A | A | D | A | D | A |
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题为0分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BC | B | AD | AB | D | BD | D | B | AB | C |
三、(本题包括3小题,共28分)
21.(10分)
⑴加入NaOH溶液并过滤(2分)
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
⑵通入Cl2(1分) 2FeCl2+Cl2=2FeCl3
⑶加热(1分) 2NaHCO3Na2CO3+CO2↑+H2O
22.(6分)
⑴②(1分) 无污染物产生,节约原料(2分)
⑵品红溶液褪色(1分) SO2水溶液具有漂白性(1分) 溶液变红色(1分)
23.(12分)⑴Br2(2分) Fe3+
⑵
| 选用试剂 | 实验现象 | |
| 第一种方法 | C(1分) | 有机层无色(1分) |
| 第二种方法 | D(1分) | 溶液变红(1分) |
| 第三种方法 | B(1分) | 产生红褐色沉淀(1分) |
⑶Fe3+ 2Fe2++4Br-+Cl2=2Fe3++2Br2+6Cl-
24.(12分)
⑴N(1分) Cu(1分) ⑵Cu(NO3)2(1分) NO(1分) ⑶1∶3(2分)
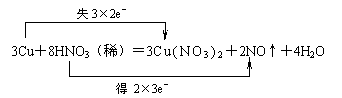
 ⑷(6分)
⑷(6分)
25.(8分)⑴使自来水中的HClO分解掉(2分)
⑵Fe、Al表面被氧化主致密的氧化物薄膜,阻止了酸与内层金属的进一步反应(即钝化现象)(3分)
⑶NH3+H2O![]()
![]() NH3·H2O
NH3·H2O![]()
![]() NH4++OH-或NH3·H2O
NH4++OH-或NH3·H2O![]()
![]() NH4++OH-(3分)
NH4++OH-(3分)
26.(10分)
A:NaOH B:Na2SO4 C:Ba(NO3)2 D:HNO3 X:Fe2(SO4)3
27.(8分)⑴13.5(4分) ⑵14.25(4分)
28.(14分)⑴Ba2++CO32-=BaCO3↓ Ba2++SO42-=BaSO4↓
BaCO3+2H+=Ba2++CO2↑+H2O
⑵0.2(2分) ⑶1.12(2分) ⑷0.7mol(4分)