高一化学下学期第一次质检试题
命题人: 汪志华
本卷可能用到的原子量: H:1 C:12 O:16 Na:23 S:32 Ca:40
第Ⅰ卷(选择题,共40分)
一、选择题(本题共20个小题,每小题只有一个选项符合题意,共40分)
1.某元素由化合态变为游离态( )
A.一定是被氧化 B.一定是被还原
C.可能是被氧化,也可能是被还原 D.不发生氧化还原反应
2.钠原子与钠离子的相同之处是( )
A.微粒半径 B.核电荷数 C.物理性质 D.化学性质
3.LiH是一种离子化合物,可作为生氢剂,与水反应的化学方程式为
LiH+H2O=LiOH+H2↑,下列说法正确的是( )
A.H2O是还原剂 B. H2O既不是氧化剂,也不是还原剂
C.Li+比H-多一个电子层 D.LiH中氢负离子的电子式为[:H]-
4.下列属于同位素的是( )
A. H、D、T B. K 、Ca C.C60、C72、C84 D. 氧气和臭氧
5.下列离子方程式书写正确的是( )
A.钠投入水中: 2Na+2H2O=Na++2OH-+H2↑B.2Fe+6H+=2Fe3++3H2 C.HI+Ag+=AgI+H+ D.向AlCl3溶液中加入过量NaOH溶液得到澄清溶液Al3++4OH-=AlO2-+2H2O
6.下列关系不正确的是( )
A.氧化性:I2<Br2<Cl2<F2 B.酸性:HIO4<HBrO4<HClO4
C.还原性:HI>HBr>HCl>HF D.熔点:F2>Cl2>Br2>I2
7.某元素原子的最外层电子数是次外层的a倍(a为大于1的整数),则该原子的核内质子数为( )
A.2a+2 B.2a+10 C.a+2 D.2a
8.某生产商拟用自来水装入瓶中作纯净水销售,请你选用一种试剂把它检测出来,以证明他的非法生产。这种试剂是( )
A.Cl2 B.Na2CO3 C.盐酸 D.AgNO3
9.下列各微粒都与氩原子具有相同电子层结构的是( )
A.O2-、F-、Na+ B.Cl-、K+、S2- C.Na+、K+、S2- D.Na+、Mg2+、Al3+
10.下列离子化合物中既有离子键又有非极性的是( )
A.NaOH B. H2O2 C.NH4Cl D.Na2O2
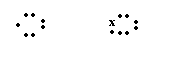 11.下列式子正确的是( )
11.下列式子正确的是( )

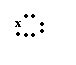 A.Hx+ Cl
→
H+ [ Cl
] -
A.Hx+ Cl
→
H+ [ Cl
] -
![]()
![]()
![]()
![]() B.xMgx +2 Cl
→
Mg2+
[ Cl
] 2-
B.xMgx +2 Cl
→
Mg2+
[ Cl
] 2-
![]()
![]()

![]()

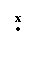
![]()

|
|

|
|
12.下列说法正确的是( )
A.IA族元素都是活泼的碱金属元素 B.所有原子都是由质子、中子、电子构成的
C.F-、Cl-、Br-、I-的离子半径依次增大,还原性依次增强
D.Na、Mg、Al在一定条件下都与水反应,生成的碱都能使无色酚酞试液变红
13.含3.01×1023个中子的 Li的质量为( )
A.0.50g B.0.625g C.0.875g D.1.000g
14.已知A2-、B-、C+、D2+、E3+五种简单离子核的电子数相等,则它们对应的原子序数由大到小的顺序是( )
A.A>B>C>D>E B. E>D>C>B>A C.C>D>E>A>B D. B>A>C>D>E
15.下列微粒所带电荷与电子层数相同的是( )
A.H+ B.Mg2+ C.Al3+ D.S2-
16.下列叙述中,正确的是( )
A.含金属元素的离子不一定都是阳离子 B.在氧化还原反应中,非金属单质一定是氧化剂
C.含有共价健的化合物,一定是共价化合物 D.完全由非金属元素不可能形成离子化合物
17.下列微粒半径之比大于1的是( )
A. B. C. D.
18.下列各原子构成的单质中,肯定能与稀硫酸反应生成H2的是( )
A.原子核内没有中子 B.M层有5个电子
C.原子核的最外层电子数等于电子层数
D.N层上电子数与K层电子数相等,次外层有8个电子
19.下列说法正确的是( )
A.质子数和电子数相等的粒子一定是原子
B.两种粒子如果核外电子排布相同,化学性质就一定相同
C.质量数相同的原子其化学性质一定相同
D.具有相同核电荷数的原子或简单的离子,一定是同种元素
20.10g由H和O两种原子组成的重水(D2O),所含的中子数为( )
A.3.01×1023 B.3.01×1024 C.6.02×1023 D.6.02×1024
高一化学下学期第一次质检试题
高一化学(理科)答题卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共60分)
![]()
 二、简答题(共53分)
二、简答题(共53分)
21(11分) 有A、B、 C、D、E五种元素,它们的质子数依次递增,但都小于18;A元素原子核外只有1个电子,B元素原子和C元素原子最外层电子数之差为2,B元素原子最外层上的电子数为次外层电子数的2倍。B、 C 、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色。0.5mol E元素的单质与足量的酸反应有1.5mol电子发生转移.
(1)写出五种元素的名称:A B C D E (5分)
(2)比较C、D、E三种离子半径的大小(用>连接离子符号)
(2分)
(3)写出D2C2和BC2的电子式 (2分)
(4)写出D2C2和A2C反应的离子方程式 (2分)
22.(22分)下表为元素周期表的一部分,用化学符号回答下列问题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
| ⑥ |
| ⑦ |
|
|
| 3 | ① | ③ | ⑤ |
|
|
| ⑧ | ⑩ |
| 4 | ② | ④ |
|
|
|
| ⑨ |
|
(1)10种元素中,化学性质最不活泼的是
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是
(3)①②③三种元素形成的离子半径由大到小的顺序为
(4)元素⑦的氢化物的化学式为 ;该氢化物和元素②单质反应的化学方程式为:
(5)①⑨形成的化合物电子式为 ;该化合物灼烧时的焰色为 ;该化合物的溶液与元素⑧的单质反应的化学方程式为:
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式:
(7)⑥⑧形成化合物的电子式为 ;单质⑨溶入该化合物所得溶液的颜色为 ;
23.(6分)有若干克某金属,其中中子总数为3.5×6.02×1023,同质量的该金属和足量的稀硫酸反应,共有0.2mol电子发生转移生成6.02×1022个阳离子,这些阳离子共有3.0×6.02×1023个质子,则该金属的相对原子质量为 。若用x表示该金属的元素符号,该金属元素的原子的组成符号为 ,该金属与稀硫酸发生反应的离子方程式为
.
24.(14分)用不同的实验方法证明Na、Mg、Al的金属性变化顺序,设计了如下方案,并记录了有关实验现象。
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中 2.将镁条用沙纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向试管中滴加酚酞溶液 3.将镁条投入稀盐酸中 4.将铝条投入稀盐酸中 |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不是很剧烈,产生无色气体 D.有气体产生,溶液变成浅红色 |
(1)填写与实验步骤对应的实验现象编号
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
|
|
|
|
(2)写出镁与水反应的化学方程式:
(3)实验结论:
(4)用原子结构理论解释上述结论:
三、计算题(7分)
25.(7分)将1.720g CaSO4·XH2O加热,使其失去全部结晶水,这时剩余固体物质的质量为1.360g.计算1mol此结晶水合物中所含结晶水的物质的量.
高一化学下学期第一次质检试题
高一化学(理科)答案卷
一、选择题(本题共20个小题,每小题只有一个选项符合题意,共40分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | D | A | D | D | A | D | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | C | C | B | B | A | D | D | D | B |
二、简答题(共43分)
21(11分) 有A、B、 C、D、E五种元素,它们的质子数依次递增,但都小于18;A元素原子核外只有1个电子,B元素原子和C元素原子最外层电子数之差为2,B元素原子最外层上的电子数为次外层电子数的2倍。B、 C 、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色。0.5mol E元素的单质与足量的酸反应有1.5mol电子发生转移.
(1)写出五种元素的名称:A 氢 B 碳 C 氧 D 钠 E铝 (5分)
(2)比较C、D、E三种离子半径的大小(用>连接离子符号)
O2- > Na+ > Al3+ (2分)
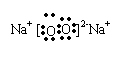 | 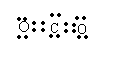 | ||
(3)写出D2C2和BC2的电子式 (2分)
(4)写出D2C2和A2C反应的离子方程式 2Na2O2+2H2O=4Na++4OH—+O·↑ (2分)
22.(22分)下表为元素周期表的一部分,用化学符号回答下列问题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
| ⑥ |
| ⑦ |
|
|
| 3 | ① | ③ | ⑤ |
|
|
| ⑧ | ⑩ |
| 4 | ② | ④ |
|
|
|
| ⑨ |
|
(1)10种元素中,化学性质最不活泼的是 Ar (2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是 KOH
(3)①②③三种元素形成的离子半径由大到小的顺序为 K+ > Na+ > Mg2+
(4)元素⑦的氢化物的化学式为 H2O ;该氢化物和元素②单质反应的化学方程式为:
2K+2H2O=2KOH+H2↑
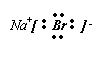 |
(5)①⑨形成的化合物电子式为 ;该化合物灼烧时的焰色为 黄色 ;该化合物的溶液与元素⑧的单质反应的化学方程式为: Cl2 +2NaBr=2NaCl+Br2
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式:OH-+Al(OH)3=AlO2-+2H2O
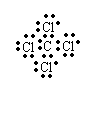
(7)⑥⑧形成化合物的电子式为 ;单质⑨溶入该化合物所得溶液的颜色为 红棕色;
23.(6分)有若干克某金属,其中中子总数为3.5×6.02×1023,同质量的该金属和足量的稀硫酸反应,共有0.2mol电子发生转移生成6.02×1022个阳离子,这些阳离子共有3.0×6.02×1023个质子,则该金属的相对原子质量为
65 。若用x表示该金属的元素符号,该金属元素的原子的组成符号为
![]() ,该金属与稀硫酸发生反应的离子方程式为
,该金属与稀硫酸发生反应的离子方程式为
X+2H+ =H2↑+X+ .
24.(14分)用不同的实验方法证明Na、Mg、Al的金属性变化顺序,设计了如下方案,并记录了有关实验现象。
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中 2.将镁条用沙纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向试管中滴加酚酞溶液 3.将镁条投入稀盐酸中 4.将铝条投入稀盐酸中 |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不是很剧烈,产生无色气体 D.有气体产生,溶液变成浅红色 |
(1)填写与实验步骤对应的实验现象编号
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
(2)写出镁与水反应的化学方程式: Mg+2H2O △ Mg(OH)2+H2↑
(3)实验结论: 随钠、镁、铝的顺序金属性减弱
(4)用原子结构理论解释上述结论: 钠、镁、铝电子层数相同,随原子序数递增,原子半径减小,核对最外层电子的吸引减弱,失电子能力增强,所以金属性增强。
三、计算题(7分)
25.(7分)将1.720g CaSO4·XH2O加热,使其失去全部结晶水,这时剩余固体物质的质量为1.360g.计算1mol此结晶水合物中所含结晶水的物质的量.
解: CaSO4·xH2O=CaSO4+xH2O
n(CaSO4·xH2O)=n(CaSO4)=1.36g÷136g·mol-
=0.01mol
n(H2O)=(1.720g-1.360g)÷18g·mol-=0.02mol
1mol:x=0.01mol:0.02mol
x=2mol
答:1mol此结晶水合物含结晶水2mol。