高一化学下期期末综合练习
第I卷 选择题(共48分)
一、选择题(本题共24小题,每小题只有一个正确答案,每小题2分,共48分)
1.在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧 B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应 D.亚硫酸钠与稀硫酸反应
2.能正确表示下列反应的离子方程式是( )
A.碳酸钙与盐酸反应 :CaCO3+2H+ ==Ca2+ +CO2↑+H2O
B.氯气与水反应:Cl2+H2O==2H+ +Cl- +ClO-
C.硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-==BaSO4 ↓
D.金属铁放入稀硫酸中反应:2Fe + 6H+==2Fe3++ 3H2↑
3.已知阴离子 aXm-与阳离子bYn+ 具有相同的核外电子排布,下列关系式中正确的是()
A.a=b+m+n B.a=b-m-n C.a=b+m-n D.a=b-m+n
4.在标准状况下,将2g氦气、1.4g氮气和1.6g氧气混合,该混合气体的体积为( )
A.6.72L B.7.84L C.10.08L D.13.44L
5.NA代表阿伏加德常数,下列说法正确的是 ( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
6.向0.1mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )
A.Na+、CO32- B.Na+、HCO3- C.HCO3-、CO32- D.Na+、OH-
7.相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4 (高氯酸钾)和KCl。下列关于①和②的说法不正确的是( )
A.都属于氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量相同
8、能把Na2SO3、Na2SO4、Na2SiO3三种无色溶液区分开的一种试剂是
A、Ba (OH)2 溶液 B、紫色石蕊试液 C、CaCl2溶液 D、盐酸
9、下列物质中,只有极性键的是
A、Na2O2 B、Cl2 C、CH4 D、H2O2
10、下列变化的实质相似的是
A、浓硫酸和浓盐酸在空气中敞口放置时浓度均减小 B、SO2和Cl2 均能使品红溶液褪色
C、浓硫酸和稀硫酸与锌反应均产生气体 D、HBr、HI气体都不能用浓硫酸干燥
11、下列结论正确的是
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A、①③④ B、②④⑥ C、① D、⑥
12.甲、乙两元素原子的L层电子数都是其它层电子总数的2倍。下列推断正确的是:
A. 甲与乙的单质一定都不能与水反应 B. 甲与乙处于同一主族
C. 甲与乙的原子序数之和一定为18 D. 甲与乙处于同一周期
13.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A. 硫酸氢钠溶于水 B. 将SO2通入水中 C. 烧碱溶于水 D. 将HCl通入水中
14.在S+2KNO3+3C=3CO2+K2S+N2↑的反应中,若有32g S被还原,则被S氧化的C质量是
A. 36g B. 24g C. 12g D. 6g
15、将SO2气体通入含有大量下列物质的溶液中,几乎不发生反应的是( )
①NaHSO3 ②Na2SO3 ③NaOH ④NaClO ⑤NaNO3 ⑥氯水
A. 仅①⑤ B.仅① C.①④⑤ D. ②④⑤⑥
16.将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3 C. Na2CO3、SiO2 D. SiO2
17.用适量的原料经玻璃熔炉反应后制取的普通玻璃中,含钠9.6%,含钙8.4%,含硅35.1%。习惯上可用下列哪个化学式来表示该玻璃的组成
A. Na2O·CaO·SiO2 B. 2Na·CaO·6SiO2 C. Na2O·CaO·6SiO2 D. Na2O·CaO·5SiO2
18、下列说法中,正确的是
A、双原子分子中的共价键,一定是非极性键
B、任何原子的原子核都是由质子和中子构成的
C、非极性键也可能存在于离子化合物中
D、质子数相同的微粒,它们的化学性质基本相同
19、原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,
原子核内质子数是2n2-1。下列有关X的说法中不正确的是
A、X能形成化学式X(OH)3的碱
B、X可能形成化学式KXO3的含氧酸钾盐
C、X原子的最外层电子数和核电荷数肯定为奇数
D、X不能与某些金属元素形成化合物
20、在氧气中灼烧0.485g某金属硫化物,使硫全部转化为SO2,SO2再转化为硫酸、这些硫酸可用20mL0.5mol/L的NaOH溶液完全中和,则原硫化物是 ( )
A、FeS2 B、ZnS C、FeS D、Cu2S
21.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应
Fe2O3+3Na2O2![]()
A.Na2O2既是氧化剂又是还原剂 B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
22、向含1mol HCl和1mol MgSO4的盐酸与硫酸镁的混合溶液中,逐滴加入1mol·L-1的
Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
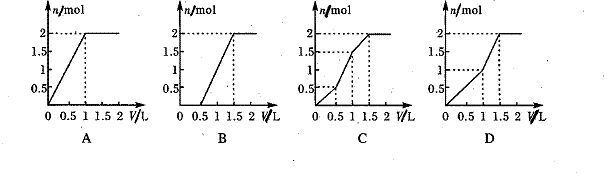
姓名: 学号: 得分:
第II卷 非选择题(60分)
二、填空题(每空1分,共35分)
23、古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸上,商人们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体,这种固体成分为 ,其主要反应的化学方程式为
24、元素的种类决定于 ,元素是否有同位素取决于 ,元素的化学性质主要决定于 ,在原子序数1-18号的元素中酸性最强的含氧酸是(填化学式,下同) ,最稳定的气态氢化物是 。
25. 某盐A跟某酸B在一定条件下反应,生成具有刺激性气味的气体C,溶液里含有D。C和氢氧化钠溶液反应可生成A。
(1)若C被氧化后生成E,E跟氢氧化钠溶液反应生成D,则符合题意的A是 (名称,下同),B是 。
 (2)若C被氧化后生成E,E跟氢氧化钠溶液反应的生成物中含有A,则符合题意的A是 ,B是 。
(2)若C被氧化后生成E,E跟氢氧化钠溶液反应的生成物中含有A,则符合题意的A是 ,B是 。
26. 右表是元素周期表中的一部分,已知B可分别与A、C、D形成AB2、CB2、DB2型化合物;A分别与D、E还可以形成AD2、AE4型化合物;又知A原子最外层电子数是次外层电子数的两倍,请填写下列空格。
(1)写出B、C、D、E四种元素的名称: B ,C ,D ,E 。
(2)写出AB2、AD2的化学式 、 。
(3)C、D、E最高价氧化物的水化物化学式为 、 、 ,其中酸性最弱的是 ,它与烧碱反应的离子方程式为 。
27.(1)工业上制造普通玻璃的原料是 、 、
(2)高岭石的组成为Al2(Si2O5)(OH)4,若改用氧化物的形式表示其组成为
28. A、B、C、D是短周期中原子序数依次增大的四种元素。已知C原子最外层电子数是次外层电子数的1/2,B的核电荷数比A多2个,D原子核中的质子数比B多3个;1mol单质A跟酸完全反应时,产生1g氢气。
写出:(1)C原子结构示意图 它在元素周期表中的位置是
(2)A元素的最高价氧化物对应水化物的电子式
(3)用电子式表示D元素形成气态氢化物的过程:
(4)A、D两元素的最高价氧化物对应水化物分别与B的最高价氧化物对应水化物反应的离子方程式
29.如下图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。据图填写:
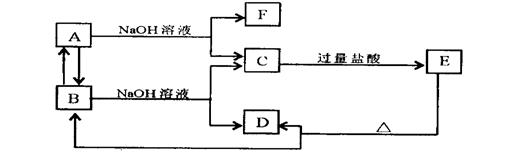
(1)B的化学式
(2)B和NaOH溶液反应的离子方程式是
(3)C和过量盐酸反应的离子方程式是
![]() (4)B A反应的化学方程式是
(4)B A反应的化学方程式是
三、实验题(每空1分,共17分)
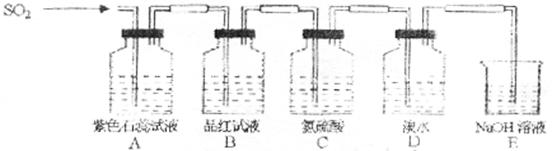 30.已知在溶液中Cl2可氧化SO2:Cl2+SO2+2H2O=2HCl+H2SO4。下图是有关SO2性质的实验装置,试回答下列问题:
30.已知在溶液中Cl2可氧化SO2:Cl2+SO2+2H2O=2HCl+H2SO4。下图是有关SO2性质的实验装置,试回答下列问题:
(1)A、B、C、D四个装置中发生的现象分别是______________、______________、
______________、______________。
(2)SO2具有下列性质:①漂白性 ②酸性氧化物的性质 ③还原性 ④氧化性。在图中几个装置中SO2表现的性质依次是:A中______、B中______、C中______、D中___ ___。
(3)实验完毕后,取B中溶液少许于试管中加热,发生的现象是_______________,其原因是__________________________________________。
(4)实验完毕后,取D中溶液少许于试管中,加入BaCl2溶液和稀盐酸,现象是________。
(5)E中发生的反应的离子方程式为_________________________。
31.(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应都用如下图所示的实验装置进行实验,通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
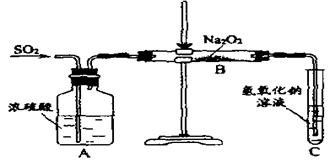
试回答下列问题:
(1) 第1小组同学认为反应生成了Na2SO3和O2,该反应的化学方程式为
(2)请设计一种实验方案证明Na2O2和SO2反应生成的白色固体中含Na2SO3。
(3)第2小组同学认为Na2O2和SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下方案
|
|
|
|
|
上述方案是否合理: 请简要说明理由
①
②
四、计算题(共8分)
32.已知SO2 和H2S两种气体可以发生如下反应:2H2S + SO2 == 3S +2H2O
(1)常温下,向20L真空容器中通人a mol H2S 和 b mol SO2 (a、b都是正整数,且a≤5,b≤5)反应完成后,容器内气体可能达到的最大密度为 g/L
(2)在室温条件下,在一体积不变的的密闭容器中充入H2S和SO2气体,反应前压强为p,反应结束后压强为p/2,则反应前H2S和SO2的体积比是 或 。
高一下期期末化学综合练习
参考答案
1.A 2.A 3.B 4.D 5.D 6.B 7.D 8、D 9、C 10、D 11、B
12、C 13、A 14、D 15、B 16、A 17、C 18、C 19、A 20、B 21、B 22、C
23、Na2SiO3和SiO2,
Na2CO3+SiO2 ![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
24、核电荷数(质子数) 中子数 最外层电子数 HClO4 HF
25. (1)亚硫酸钠 硫酸 (2)氯化钠 浓硫酸
26. (1)氧 硅 硫 氯 (2) CO2、CS2
(3) H2SiO3 (或H4SiO4) H2SO4 HClO4 H2SiO3 H2SiO3+2OH- == SiO32-+2H2O
 27. (1)石英、石灰石、纯碱
(2)Al2O3·2SiO2·2H2O
27. (1)石英、石灰石、纯碱
(2)Al2O3·2SiO2·2H2O
28. Si 3周期 ⅣA 族
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (2)Na+[ O
H]- (3H
+ S + H
H S H
(2)Na+[ O
H]- (3H
+ S + H
H S H
(4)Al(OH)3+OH-=AlO2-+2H2O Al(OH)3+3H+=Al3++3H2O
29. (1) SiO2 (2) SiO2+2OH-=SiO32-+H2O
(3)SiO32-+2H+=H2SiO3↓ (4)SiO2+2C![]() Si+2CO↑
Si+2CO↑
30、略
31、(1) 2Na2O2+2SO2=2Na2SO3+O2
(2) 取反应后的固体配成溶液,滴加稀盐酸看能否产生使湿润品红试纸褪色的气体。
(3) 不合理
①HNO3氧化性强,会把Na2SO3氧化为Na2SO4。
②溶于水时,若Na2O2剩余,也能把Na2SO3氧化为Na2SO4。
32、(1)14.4 (2)5 :1 或 1 :2