高一化学上学期期中测试
考试时间:60分钟 满分:100分
命题:顾备战
可能用到的原子量:Ca:40;Mg:24;O:16;Na:23;S:16;H:1
一、选一选,只有一个是你要的,快点答题,别浪费时间哦(本题包含10小题,每题3分,共30分)
1.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.牛奶久置变质腐败
D.用醋酸除去水垢[主要成分是CaCO3、Mg (OH)2]
2.实验表明,不能用块状大理石与稀硫酸制取CO2气体,而能用大理石粉末与稀硫酸制取CO2气体。由此得出的合理结论是
A、发生反应的物质之间是否发生反应,与反应的条件有关
B、反应物之间接触面积越大,越有利于反应的进行
C、块状大理石与大理石粉末的化学性质不同
D、块状大理石与大理石粉末中各元素原子间电子的结合状况不同
3.Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
A.Na2CO3是碱 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
4.下列各组中的物质都是电解质的是
A.铜、氯化钠、硫酸、氨水 B.氨气、二氧化碳、蔗糖、硝酸
C.硫酸钡、硫酸、氧化钙、氢氧化钡 D.氯化银、盐酸、氢氧化钠、酒精
5.近来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的
A.溶液 B.悬浊液 C.乳浊液 D.胶体
6.现有三种常见治疗胃病药品的标签:

① ② ③
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
7.2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃反应领域研究方面所取得的成就。下面是他们研究烯烃反应的示意图:
 该反应属于四种反应类型中的
该反应属于四种反应类型中的
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.将100 g质量分数为37%的浓盐酸加热蒸发掉30 g水,则盐酸的浓度将
A.减小 B.增大 C.不变 D.无法确定
9.钠、镁、铝三种金属单质的混合物跟足量的稀硫酸溶液充分反应后,得到标准状况氢气2.24L,则这三种金属的总的物质的量可能是
A、0.050mol B、0.060mol C、0.100mol D、0.200mol
10.将5 mol·L-1硫酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是
A、0.05 mol·L-1 B、0.25 mol·L-1 C、0.1 mol·L-1 D、0.5 mol·L-1
二、选一选、选二选,这个你自己决定吧,考虑要全面哦(本题包含6小题,每题4分,共24分)
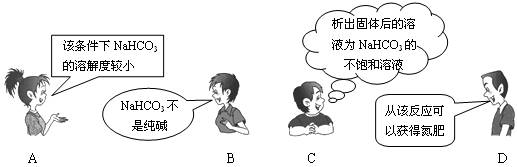
11."NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl"是著名的"侯氏制碱法"的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
12.在下列各用途中,利用了物质的氧化性的是:
A.用食盐腌渍食物 B.用盐酸除去铁钉表面的铁锈
C.用汽油擦洗衣料上的油污 D.用漂粉精给游泳池中的水消毒
13.人体正常的血红蛋白中含有Fe2+,若误服NaNO2,则导致血红蛋白中Fe2+转变为高铁血红蛋白而中毒。服用维生素C可解除NaNO2中毒。下列有关叙述正确的是
A. NaNO2是还原剂 B. 维生素 C是氧化剂
C. 维生素C将NaNO2还原 D. 维生素C被氧化
14.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,反应后Na2SO3转化为Na2SO4,则反应物NaClO3和Na2SO3的物质的量之比为
A.1∶1 B.1∶2 C.2∶1 D.3∶1
15.物质的量浓度相同的NaCl、MgCl2、FeCl3溶液,分别与等体积等物质的量浓度的AgNO3溶液完全反应,所用去三种溶液的体积比为
A. 6:3:2 B. 1:2:3 C. 3:2:1 D. 1/3:1/2:1
16.设N为阿伏加德罗常数值,若a g某气体中含有分子数b,则c g该气体在标准状况下的体积是
A.22.4ab/cN L B.22.4ac/bN L C.22.4b/acN L D.22.4bc/aN L
 选择题答案填写表格:
选择题答案填写表格:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
三、想一想,试试你的实践能力,不要乱了思维哦(本题包含2小题)
17.(本题6分)含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:镁铝合金![]() 溶液
溶液![]() 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;
实验设计2:镁铝合金![]() 生成的气体在标准状况下的体积为V1L。
生成的气体在标准状况下的体积为V1L。
请回答以下问题:
(1)写出实验设计1中单质铝发生反应的第①步离子方程式:________________________________
(2)写出实验设计2中反应的离子方程式:________________________________________________
18.(本题6分)配制100 mL 1.10mol·L-1NaOH溶液时,某学生操作如下:将准确称量的4.4 g NaOH固体放入烧杯中,加入约30 mL蒸馏水,用玻璃棒搅拌使其溶解后,立即将烧杯中溶液注入100 mL容量瓶中,然后往容量瓶中小心加蒸馏水,直到液面接近刻度1cm ~ 2cm处,改用胶头滴管加蒸馏水,使溶液凹液面的最低点恰好与刻度线相切,再把容量瓶塞子塞紧,振荡摇匀。
(1)该生操作中的错误有:
。
(2)该学生称量4.4 g NaOH时不小心是将NaOH放在右盘,砝码放在左盘(1g以下用游码)进行的,这项操作将导致实际称得的NaOH固体质量 (填"偏大"、"偏小"或"无影响"),最后所配溶液的物质的量浓度是 mol·L-1。
四、填一填,别大意,我不难吆,但要细心哦(本题包含2小题)
19.(本题8分)化学中有许多概念是相对的,又是统一的。右图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
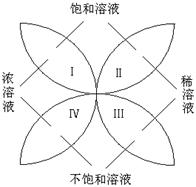 (1)从右图可以看出,饱和溶液与浓溶液、稀溶液的关系是
。
(1)从右图可以看出,饱和溶液与浓溶液、稀溶液的关系是
。
(2)0.9%的医用生理盐水可归于右图中 区域(选填"Ⅰ"、"Ⅱ"、"Ⅲ"或"Ⅳ");现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是
或 。
(3)生产上要配制6L1mol/L的盐酸来清洗钢材,需36.5%的盐酸(密度为1.2g/cm3)__________mL。
20.(本题10分)世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧州和我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同时会产生Cl2。该法制ClO2的化学方程式为
2NaClO3+4HCl == 2ClO2↑+Cl2↑+2NaCl+2H2O
(1)若生成0.1mol Cl2,转移的电子的物质的量为 ,该反应中氧化产物为 。
(2)在题中化学方程式中标出电子的转移的方向和数目。
(2)盐酸在反应中显示出来的性质是:(填写编号) 。两者的物质的量之比 。
①具有还原性和不稳定性 ② 具有酸性和氧化性 ③有氧化性和不稳定性 ④具有酸性与还原性
五、算一算,我不繁,但注意你的仪表和表达哦,不要紧张,很快你就要胜利啦(本题包含2小题,每题8分,共16分)
21.某温度下,一定量的某Na2SO3溶液的溶质质量分数为20%,在该溶液中加入1g Na2SO3·7H2O晶体后成为饱和溶液,此时溶液的体积为15.0mL,溶质质量分数为22%。试求:
(1)该温度下亚硫酸钠的溶解度。
(2)此时亚硫酸钠的物质的量浓度。
22.有一表面被氧化成氧化钠的金属样品5.22g,投入到100g水中,产生气体2.24L(标况)。求:
⑴、此样品中单质钠的物质的量?
⑵、所得溶液溶质的质量分数?
参考答案
1.D 2.B 3.A 4.C 5.D 6.C 7.D 8.A 9.C 10.B(3×10)
11. C 12.D 13. D 14.C 15.A 16.D (4×6)
17(4分).(1)![]()
(2)2Al+2H2O+2OH-= 2AlO2-+3H2
18(8分).(1)有三处错误:NaOH加水溶解后未冷却至室温就立即注入容量瓶中;将溶液注入容量瓶时未用玻璃棒小心引流;溶解NaOH用的烧杯未用适量蒸馏水洗涤2~3次,并将洗涤后的溶液一并转入容量瓶。(每种情况2分,共6分)
(2)偏小 ;0.90(每空1分,共2分)
19(8分).(1)饱和溶液既可能是浓溶液,也可能是稀溶液
(2)Ⅲ 加入NaCl固体,至不再继续溶解 蒸发溶剂至刚好有晶体析出
(3)500
20(10分).(1)0.2mol Cl2 (2) 略 (3)④ 1:1
21.⑴28.2 g (4分) ⑵1.75 mol/L (4分)
22.(1)n(H2)=0.1 mol (1分),由2Na+2H2O=== 2 Na+ +2 OH-+H2↑(1分)
得n(Na)=0.2 mol(1分)
(2) m(Na)=4.6 g,所得n(NaOH)= 0.2 mol (1分)
m(Na2O)=0.62 g,所得n(NaOH)= 0.02 mol (1分)
m(NaOH)=0.22 mol×40 g·mol-1 =8.8 g (1分)
ω(NaOH) =![]() (2分)
(2分)