高一化学上学期期中考试试题
化学试题 11月 袁金坤
考试时间:80分钟 总分100分
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Mg:24 Al:27 Cl:35.5 Na:23
请将选择题的选项填入题后对应表格。
第Ⅰ卷 选择题(共55分)
一 选择题(每题只有一个选项符合题意,每小题2分,共40分)
1、据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾(分散质粒子直径在10-9----10-7m)属于下列哪种分散系:
A 乳浊液 B 溶液 C 胶体 D 悬浊液
2、下列物质放置在空气中因发生氧化还原反应而变质的是
A.NaOH B.Na2O C.Na D.CaO
3、下列名称和化学式相对应正确的一组是:
A 小苏打----- NaOH B 苏打------ CaCO3
C 苛性纳------ NaHCO3 D 纯碱----- Na2CO3
4、核工业中常作快中子反应堆的热交换剂的是:
A 钠钾合金 B 镁合金 C 冷水 D 空气
5、在酸性溶液中,可大量共存的离子是
A K+ Na+ OH- SO42- B Mg2+ SO42- NH4+ Cl-
C K+ Na+ HCO3- Cl- D K+ Na+ NO3- CO32-
6、在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为:
A、单质 B、分子 C、元素 D、氧化物
7、下列化学反应基本类型中一定是氧化还原反应的是:
A 化合反应 B 分解反应 C 复分解反应 D 置换反应
8、保存少量金属钠的正确方法是放入
A 水中 B 煤油中 C 蜡中 D 中空的广口中
9、下列溶液中不存在氯离子的是:
A 氯水 B 氯化钠溶液 C 漂白粉溶液 D 氯酸钾溶液
10、下列离子方程式正确的是:
A 用氢氧化钠溶液来吸收氯气 NaOH + Cl2 = 2Na+ + Cl― + ClO― + H2 O
B 钠与水的反应 Na + 2H2 O = Na+ + 2OH- + H2↑
C 铜片插入硝酸银溶液 Cu + Ag+ = Cu2+ + Ag
D 溴水滴入碘化钾溶液: 2Br― + I2 === Br2 + 2I―
11、下列叙述中能证明次氯酸是一种弱酸的是:
A、次氯酸不稳定,易分解 B、次氯酸钙能与碳酸作用生成碳酸钙和次氯酸
C、次氯酸是一种强氧化剂 D、次氯酸能使染料和有机色质褪色
12、下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是:
A 生灰石 B 氢氧化钙 C 碳酸钙 D 熟石灰
13、下列关于Na和Na+的叙述中,错误的是:
A.它们相差一个电子层 B.它们的化学性质相似
C.钠原子,钠离子均为同一元素 D.灼烧时,它们的焰色反应都呈黄色
14、下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是:
A 碘水 B 氯水 C 溴水 D 氯化钠溶液
15、患甲状腺肿大是边远山区常见的地方病,下列元素对该病有治疗作用的是:
A.钠元素 B.氯元素 C.碘元素 D.铁元素
16、对于相同物质的量的SO2和SO3,下列说法中正确的是
A 氧元素的质量比为1∶1 B 分子数之比为1∶1
C 原子总数之比为1∶1 D 质量之比为1∶1
17、下列物质中属于电解质的是
A NaCl晶体 B CO2 C NaCl溶液 D Fe
18、下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个Cl2分子的质量为35.5g D.标准状况下,1 mol任何物质体积均为22.4L
19、苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有:
A.氧化性 B.还原性 C.碱性 D.酸性
20、钠在自然界中不可能的存在形式是:
A.游离态 B.氯化钠 C.硫酸钠 D.硝酸钠
二、多项选择题(每题有1—2个选项,每题3分,漏选得1分,错选或不选不得分)
21、镁粉在焰火、闪光灯中是不可缺少的原料,工业上制造镁粉是将镁蒸气在气体中冷却。下
列气体中,可用来冷却镁蒸气的是( )
A、空气 B、二氧化碳 C、氢气 D、氩气
22、现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
23、![]() He 可以作为核聚变材料,下列关于
He 可以作为核聚变材料,下列关于![]() He的叙述正确的是
He的叙述正确的是
A. ![]() He 和
He 和![]() H 互为同位素
H 互为同位素
B. ![]() He 原子核内中子数为2
He 原子核内中子数为2
C. ![]() He 原子核外电子数为2
He 原子核外电子数为2
D. ![]() He 代表有2个质子和3个中子的氦原子
He 代表有2个质子和3个中子的氦原子
24、将少量氯水加入KI稀溶液中振荡,再加入CCl4,振荡,静置后观察到的现象是:
A 形成均匀的紫红色溶液 B 有紫色沉淀析出
C 液体分层,上层呈紫红色 D 液体分层,下层呈紫红色
25、下列关于碳酸钠的说法正确的是:
A 同条件下,水中溶解度小于碳酸氢钠
B 同条件下,盐酸中反应速率大于碳酸氢钠
C 热稳定性大于碳酸氢钠
D 固体中混有碳酸氢钠时可通过加热法除去杂质
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 选项 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 选项 |
第Ⅱ卷 (非选择题 共45分)
二、(本题包括3小题,共19分)
26、(5分)2006年夏天,中国南部沿海地区洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式:
。
(2)漂白粉的有效成分是(填化学) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
27(6分)将一小块钠投入一盛有水的烧杯中,发生下列现象,请说明原因:
① 钠浮在水面上________________________;
② 钠与水剧烈反应并熔成一个闪亮的小球 ;
③小球在水面上四处游动_______________________________;
④反应后在溶液中加几滴酚酞溶液,溶液变红________________________;
⑤写出钠与水反应离子方程式
28(8分)下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合中学学过的化学知识,回答下列问题:
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20―40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
⑴据物质分类中的树状分类法有关知识,在:①HIO3 ②碘酸钠 ③KOH ④I2O5 ⑤HI
五种 (填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有 (填序号)。
⑵推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3) 溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时 。
三、本题包括2小题,共16分
29(10分)某学生设计了如下实验:
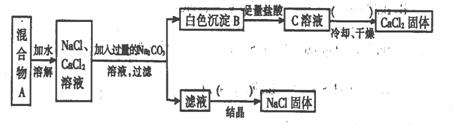 |
回答下列问题:
(1)该同学的实验目的是 ;
(2)上图括号内的操作步骤均为 ;
(3)按此实验方案得到的NaCl固体中肯定含有
(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的 ;
(4)写出生成B的离子方程式:
30(6分)实验室中需要配制500mL 0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)用天平称量NaOH固态 __ g。称量NaOH固体需注意以下两个问题:①因为NaOH具有腐蚀性,所以称量时,需注意选择用 盛装NaOH固体;
②称量必须迅速,目的是 。
(2)实验所需的仪器有容量瓶(规格是: )、托盘天平、烧杯、胶头滴管、,还有 。
(3)下列操作对所配制的溶液浓度肯定没有影响的是 。
A.称量时已观察到NaOH吸水
B.将烧杯中溶解后的溶液注入容量瓶,然后直接添加蒸馏水至刻度线
C.摇匀定容后,用胶头滴管向容量瓶中再滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶
四 本题包括1小题,共10分
31、用KMnO4与足量浓度为12mol/L的浓盐酸反应.反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
回答下列问题:
(1)该反应中的氧化剂是 、氧化产物是 。
(2)2molKMnO4完全反应,至少需要HCl物质的量为 mol。
(3)8mol HCl完全反应,产生的Cl 2在标准状况下的体积为多少升?
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 选项 | C | C | D | A | B | C | D | B | D | D | B | C | B |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 选项 | D | C | B | A | C | B | A | CD | B | C | D | CD |
26、(1)2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 + 2H2O (2) Ca(ClO)2
(3) Ca(ClO)2 + H2O + CO2 = CaCO3 + 2HClO
27、①密度小于水 ②反应放热;钠的熔点低 ③有气体生成 ④有碱性物质生成
⑤2Na + 2H2 O = 2Na+ + 2OH- + H2↑
28、(1)化合物;② (2)能;易分解
29、(1)分离氯化钠、氯化钙 (2)加热蒸发 碳酸钠
(3)Ca2+ + CO32─ = CaCO3↓
30、(1)2.0 小烧杯 防止吸收空气中的水和二氧化碳
(2)500mL 玻璃棒 (3)D
31、(1)高锰酸钾 氯气
(2)16 (3)56