高一化学测试
【主题】 高一化学期末模拟测试
周测试
1.2005年10月12日,我国“神舟六号”在酒泉发射升空。10月17日4时33分,“神舟六号”飞船返回舱返回,在近5天5夜里,下列物质可用做航天员氧气来源的是
A.KClO3和MnO2
B.KMnO4
C.Na2O2
D.Na2CO3
1.截止到2005年11月为止,发现H5N1病毒的流行地区有:中国、越南等17个亚太地区。下列物质中,可用作禽流感流行地区消毒的是
A.NaClO溶液
B.K2SO4溶液
C.NaCl溶液
D.Na2CO3溶液
2.在下列各组物质或粒子中,只有还原性的是
A.Na、Cl-、S2-
B.Cl-、CO、Na+
C.Fe3+、SO42-、NO3-
D.Fe2+、O2、H2S
3.下列物质的保存方法不正确的是
A.新制的氯水盛放在棕色试剂瓶中
B.盛液溴的试剂瓶中常加入少量水
C.少量的金属钠应保存在煤油中
D.固态碘放在棕色细口瓶中
4.下列叙述中正确的是
A.1mol任何气体的体积一定是22.4L
B.同温同压下的两种气体,只要它们的分子数相同,所占体积也一定相同
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积不可能是22.4L
5.下列各组离子在溶液中能够大量共存的是
A.Na+、H+、Cl-、HCO3- B.K+、Mg2+、SO42-、Cl-
C.Ca2+、Na+、CO32-、NO3- D.H+、Na+、SO42-、CH3COO-
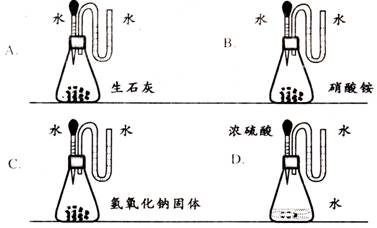
6.如图所示,挤压胶头滴管加入水或酸后,各装置“U型”管中的液柱(水)左边高于右边的是
7.能正确表示下列反应的离子方程式的是
A.铁与盐酸反应:2Fe + 6H+ == 2Fe3+ + 3H2↑
B.稀氨水中加入盐酸:OH- + H+ == H2O
C.碳酸钙溶于醋酸中:CaCO3 + 2H+ == Ca2+ + H2O + CO2↑
D.硫酸铜溶液中加入氢氧化钠溶液:Cu2+ + 2OH- == Cu(0H)2↓
8.设NA表示阿伏加德罗常数,下列说法中不正确的是
A.17gNH3含有的原子数目为10NA
B.2.3g金属钠变为钠离子时失去的电子数目为0.1 NA
C.NA个三氧化硫分子和1mol甲烷分子的质量之比为5 :1
D.NA个氧分子的质量等于氧气的摩尔质量
 9.如图所示,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是
9.如图所示,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是
A.钠悬浮在煤油层中
B.钠静止在两液面之间
C.钠沉入水底下
D.钠熔化成闪亮的小球,在两液体界面附近上下跳动
10.将少量氯水注入盛有KI溶液的试管中,再注入适量的苯,然后用力振荡,静置,产生的现象是
A.溶液呈紫色
B.上层液体呈紫红色,下层液体几乎无色
C.溶液呈无色
D.下层液体呈紫红色,上层液体几乎无色
11.已知200mLMg(NO3)2溶液中含有agMg2+,则此溶液中NO3-的物质的量浓度是
A.a/24mol·L-1 B.5a/12mol·L-1 C.5a/24mol·L-1 D.a/62mol·L-1
12.下列说法正确的是
A.按F、Cl、Br、I顺序非金属性依次增强
B.按F2、Cl2、Br2、I2顺序与水反应的剧烈程度依次增大
C.按Li、Na、K、Rb、Cs顺序,碱金属单质的还原性逐渐增强
D.按Li、Na、K、Rb、Cs顺序,碱金属原子最外层电子数逐渐增多
13.下列物质在实际应用中不是利用其化学性质的是
A.用盐酸清洗铁锈
B.氯气用于游泳池杀菌消毒
C.用加热的方法除去氯化钠固体中的少量碘
D.过氧化钠用于呼吸面具中提供氧气
14.把少量金属钠投入下列物质的溶液中,溶液的质量会减轻的是
A.HCl B.NaHCO3 C.NaOH D.MgCl2
15.已知M2O7x –和S2- 在酸性溶液中发生如下反应:M2O7x –+ 3S2- + 14H+ == 2M3+ + 3S↓+ 7H2O,则M2O7x –中M的化合价是
A.+6 B.+4 C.+3 D.+2
16.根据下列反应判断有关物质氧化性由强到弱的顺序:①2FeCl3 + 2KI == 2FeCl2 + 2KCl + I2
②2FeCl2 + Cl2 == 2FeCl3
A.Fe3+ >Cl2 >I2 B.Cl2 > Fe3+ >I2
C.I2> Cl2> Fe3+ D.Cl2> I2> Fe3+
17.某正盐的混合溶液含有四种离子,即0.2molK+、0.25molMg2+、0.4molNO3-,则SO42-的物质的量为
A.0.1mol B.0.15mol
C.0.3mol D.0.5mol
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 |
18.(1)用双线桥标出下列反应的电子转移情况
4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)上述反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
19.等物质的量SO2和SO3气体中,氧原子数之比为 ,在相同条件下它们的体积比是 。与9.6g SO2所含有的原子数相等的SO3的质量为 。
![]()
 20.已知化合物X、Y、Z、W在一定条件下可发生如下图所示的转变。又知这四种物质的焰色反应均呈黄色,且X受热分解生成Y、A和B,Z与A或B反应都生成一种单质气体。请回答下列问题:
20.已知化合物X、Y、Z、W在一定条件下可发生如下图所示的转变。又知这四种物质的焰色反应均呈黄色,且X受热分解生成Y、A和B,Z与A或B反应都生成一种单质气体。请回答下列问题:
(1)写出化学式:W ,Z 。
![]() (2)写化学方程式:X Y + A + B:
(2)写化学方程式:X Y + A + B:
;
(3)写出Y的溶液与澄清石灰水反应的离子方程式:
。
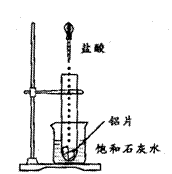
21.如图所示,向试管中加入几块铝片,再把试管放入盛有25℃饱和石灰水的小烧杯中,用铁夹固定,然后用胶头滴管加入5mL盐酸。试回答下列问题:
(1)实验时试管中的现象是铝片溶解,产生气泡。烧杯中产生的现象是 。
(2)产生上述现象的原因是 。
(3)由实验推知,AlCl3和H2的总能量 (选填“大于”、“小于”或“等于”)Al和HCl的总能量。
22.下面为配制500mL0.4mol·L-1NaCl溶液过程的部分操作流程图:
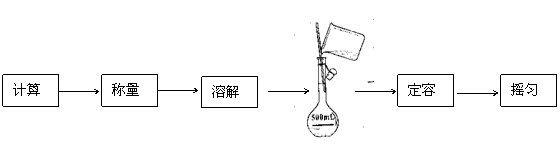 |
请回答下列问题:
(1)称量时有下列操作步骤,其中错误的有 (填序号)。
①调平衡;②在天平两端各放一张大小相等的纸;③在天平左盘内放11g砝码,将游码移至0.7g处,向天平右盘添加NaCl固体直到天平平衡;④将药品转移到烧杯中溶解,砝码放入砝码盒中,游码归位。
(2)在容量瓶上,还需标上相应的物理量是 。
(3)在上述流程图中,缺少的实验操作是 ,没有进行这步操作(其他均正常)会造成的实验结果是 (填“大于”、“小于”或“等于”)0.4mol·L-1
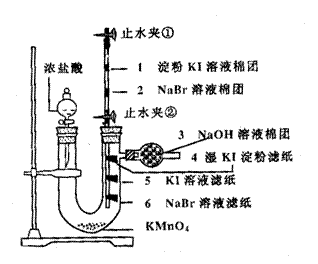 23.如图是化学工作者设计的卤素间置换反应的实验装置示意图。该装置将卤素间的置换反应设计在“两管”中,符合“绿色化学”的实验要求,是十分优秀的微型实验装置。已知高锰酸钾固体能氧化浓盐酸中的HCl生成氯气:
23.如图是化学工作者设计的卤素间置换反应的实验装置示意图。该装置将卤素间的置换反应设计在“两管”中,符合“绿色化学”的实验要求,是十分优秀的微型实验装置。已知高锰酸钾固体能氧化浓盐酸中的HCl生成氯气:
2KMnO4 + 16HCl(浓)==2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
实验操作如下:向U型管中加入约2 g高锰酸钾固体,按如右图所示安装好。关闭止水夹②。试回答下列问题:
(1)打开分液漏斗活塞,滴加浓盐酸,U型管中出现的现象是 。
(2)4处产生的现象是 。
(3)打开止水夹①、②,使氯气上升到2位置,保持一会儿即关闭止水夹②,不使氯气上升,2处产生的现象是 。取下上节玻璃管斜放,将止水夹①及胶管取下,置于玻璃管2处下端口,将其封住。向2处微微加热,1处产生的现象是 。
(4)此实验中产生的实验现象说明的问题是 。
(5)NaOH溶液棉团的作用是 。
(6)在高锰酸钾固体与盐酸的反应中,HCl的作用是 。
24.将6gNaOH固体溶于水配成500mL溶液,求:
(1)此溶液中NaOH的物质的量浓度为多少?
(2)在此溶液中通入一定量的氯气恰好完全反应,则通入的氯气在标准状况下的体积是多少升?
25.将一定质量碳酸钠和碳酸氢钠混合物加热至恒重,将产生的气体通入足量的澄清石灰水中得到沉淀ag。向加热后所得的固体物质中滴加一定物质的量浓度的稀盐酸,直到不再反应时,用去盐酸VmL,同时收集到bmL(标准状况下)气体。试计算:
(1) 若忽略溶液体积的变化,则加热后的固体与盐酸反应所得溶液中钠离子的物质的量浓度为
。
(2)原混合物中碳酸钠的质量为 。
18.(1)
|
(2)1 :2 12
19.2 :3 1 :1 9g 58%
20.(1)NaOH Na2O2
(2)2NaHCO3![]() Na2CO3
+ CO2 ↑+
H2O
Na2CO3
+ CO2 ↑+
H2O
(3)Ca2+ + CO32- ==CaCO3↓
21.(1)出现白色沉淀(或溶液浑浊)
(2)铝片与盐酸反应放出热量,温度升高,而Ca(OH)2的溶解度随着温度的升高而减少。
(3)小于
22.(1)③ (2)温度 (3)洗涤 小于
23.(1)U型管中充满黄绿色气体
(2)滤纸变蓝
(3)棉花团变黄 棉花团变蓝
(4)卤素单质氧化性由强到弱的顺序为Cl2 >Br2 >I2 (其他合理答案也可以)
(5)吸收多余的氯气 (6)还原剂 酸性
24.(1)0.3mol·L-1 (2)1.68L
25.(1)b/11.2V mol·L-1
(2)(53b/11200 – 1.06a)g (其他变形式同样给分)