高一化学上学期期末测试
可能用到的相对分子质量:H 1 C 12 O 16 Cl 35.5 Mn 55 S 32
第Ⅰ卷(选择题 共46分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.物质在相互反应时
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
2.下列物质不能作氧化剂的是
A.KNO3 B.KClO3 C.Cu D.SO2
3.以NA表示阿伏加德罗常数,下列说法正确的是
A.53 g碳酸钠中含NA个CO![]()
B.0.1 mol OH-含NA个电子
C.1.8 g重水(D2O)中含NA个中子
D.标准状况下,11.2 L臭氧中含NA个氧原子
4.下列状态的物质,既能导电又属于电解质的是
A.MgCl2晶体 B.NaCl溶液
C.液态氯化氢 D.熔融的KOH
5.“绿色商品”是指对环境无污染的商品。下列属于“绿色商品”的是
A.含氟冰箱 B.含铅汽油
C.含磷洗涤剂 D.含碘食盐
6.下列反应的离子方程式不正确的是
A.金属钠与饱和食盐水:Na+2H2O====Na++2OH-+H2↑
B.小苏打与烧碱溶液:HCO![]() +OH-====CO
+OH-====CO![]() +H2O
+H2O
C.碳酸氢钠与足量石灰水:HCO![]() +Ca2++OH-=====CaCO3↓+H2O
+Ca2++OH-=====CaCO3↓+H2O
D.用氨水吸收少量SO2:2NH3·H2O+SO2====2NH![]() +SO
+SO![]() +H2O
+H2O
7.相等质量的下列物质,所含分子数目最多的是
A.CH4 B.NH3 C.H2O D.HF
8.15.05 g卤化钾与足量的AgNO3溶液反应,可生成21.30 g沉淀,则该卤化钾的化学式为
A.KF B.KCl C.KBr D.KI
二、选择题(每小题只有一个选项符合题意,每小题3分,共30分)
9.能用H++OH-====H2O来表示的化学反应是
A.Ca(OH)2固体和H2SO4溶液反应
B.澄清石灰水和HNO3溶液反应
C.KOH溶液和醋酸溶液反应
D.氢氧化钠溶液与NaHCO3溶液反应
10.有一无色溶液,可能存在于其中的离子组是
A.K+、Na+、OH-、Cl-
B.Cu2+、Ba2+、NO![]() 、Cl-
、Cl-
C.Na+、Mg2+、OH-、SO![]()
D.Ba2+、H+、NO![]() 、CH3COO-
、CH3COO-
11.将如下卤化物跟浓H2SO4放在烧瓶中共热,可以得到纯净卤化氢气体的是
A.NaF B.NaCl C.NaBr D.NaI
12.硫代硫酸钠可作为脱氯剂,实验发现25.00 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况)Cl2完全转化为Cl-,则S2O![]() 转化成了
转化成了
A.S2- B.S C.SO![]() D.SO
D.SO![]()
13.精确配制一定物质的量浓度的NaOH溶液,下面实验操作正确的是
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶液
C.在烧杯中溶解NaOH固体后,立即将溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
14.在100 g 10%的盐酸和100 g 15%的盐酸中,分别加入2.3 g钠,钠全部反应后产生的气体
A.一样多
B.在浓度大的盐酸中反应产生的气体多
C.在浓度小的盐酸中反应产生的气体多
D.由反应剧烈程度决定
15.卤素从F到I性质递变规律正确的是
①单质的氧化性增加 ②单质颜色加深 ③单质沸点升高 ④气态氢化物稳定性增强 ⑤气态氢化物水溶液酸性增强 ⑥离子半径逐渐增大,还原性逐渐增强
A.①③⑤ B.②④⑥ C.②③⑤⑥ D.①④⑤⑥
16.下列说法正确的是
A.1 mol O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状态下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
17.在无土栽培中,要配制10 L含0.5 mol·L-1 NH4Cl、0.16 mol·L-1 KCl、0.24 mol·L-1
K2SO4的某营养液,现因无现成的KCl、K2SO4药品,而要用KCl、NH4Cl、(NH4)2SO4 三种固体配制,则需此三种固体的物质的量(mol)分别为
A.0.64、0.02、0.24 B.6.4、5.0、2.4
C.4.0、5.5、1.8 D.6.4、0.2、2.4
18.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
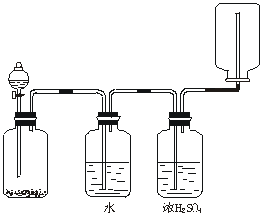
A.锌和盐酸生成氢气
B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
第Ⅱ卷 (非选择题 共54分)
三、填空题(共36分)
19.(6分)在配制一定量的物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低还是不变?
(1)用量筒取液态溶质,读数时俯视量筒,所配溶液浓度_______。
(2)将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液浓度_______。
(3)定容摇匀后,有少量溶液外流,所配溶液浓度_______。
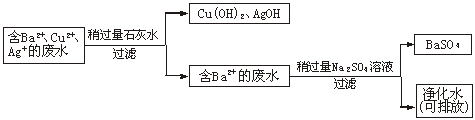
20.(8分)水污染问题是当前全世界关注的焦点问题。我们每一个人都应该自觉地保护水资源,防止污水的随意排放。化学实验过程中往往会产生污水,污水中的重金属离子如Cu2+、Ba2+、Ag+对水的污染作用很强。
某次化学实验后,回收的废液中可能含有Cu2+、Ba2+、Ag+。
(1)你认为应对该废液进行怎样的处理后才能够倒掉?
(2)写出你设计的废液处理方案及相关反应的化学方程式。
21.(12分)已知SnCl4、SiCl4、AlCl3、PCl3等氯化物在潮湿的空气中都能产生白雾。为清楚地观察磷在Cl2中燃烧,达到PCl3(常温下液态)和PCl5(常温下固态)分步生成的目的,可预先把干燥的Cl2贮存在100 mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后,组成如上图所示的装置。操作时打开弹簧夹,缓缓推动注射器的针塞,待磷燃烧出现白雾时,立即关闭弹簧夹,停止推入Cl2,片刻后,可观察到试管内白雾凝成无色液滴附着在试管内壁。然后再打开弹簧夹,继续推入Cl2,就可看到管壁上液滴逐渐消失,管内出现白雾,最后白雾凝结成白色固体附着在试管内壁上。试回答:
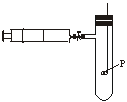
(1)该实验选择玻璃燃烧匙,不选其他金属燃烧匙的原因是______________;
(2)该实验的关键是使用的Cl2和红磷必须干燥,分析原因。(请用必要的文字和化学方程式说明)______________;
(3)第二次推入Cl2时发生的反应是(用化学方程式表示)______________,故第一次推入Cl2之所以要缓缓进行的原因是______________。
22.(10分)在盛有NaI、AgNO3、CaCl2、K2CO3、HBr的已失去标签的五种无色溶液的试剂瓶上,分别贴上①②③④⑤的编号,使它们两两反应,产生的现象在下表中列出。请在表中的结论格内,填写这些编号所代表的物质的名称。
| ① | ② | ③ | ④ | ⑤ | |
| ① | —— | 无色↑ | 白色↓ | 白色↓ | 无 |
| ② | 无色↑ | —— | 无 | 浅黄↓ | 无 |
| ③ | 白色↓ | 无 | —— | 白色↓ | 无 |
| ④ | 白色↓ | 浅黄↓ | 白色↓ | —— | 黄色↓ |
| ⑤ | 无 | 无 | 无 | 黄色↓ | —— |
| 结论 |
四、计算题(共18分)
23.(8分)将10 g小苏打样品与足量盐酸反应生成的CO2通过足量Na2O2得到1.6 g气体。计算小苏打的纯度。(假设样品不含与盐酸反应的杂质)
24.(10分)某石灰厂利用本地资源石灰石(所含杂质高温不分解,也不跟酸反应),在石灰窑内高温煅烧生产生石灰。取煅烧后的样品5.92 g,跟25.0 mL盐酸恰好完全反应,放出二氧化碳44.8 mL(标准状况),滤出残渣0.12 g。请计算:
(1)石灰石中碳酸钙的转化率(分解率)。
(2)盐酸的物质的量浓度。
参考答案:
1.解析:利用化学方程式的意义求解。
答案:D
2.解析:所含元素化合价不能降低的物质不能作氧化剂。
答案:C
3.解析:53 g Na2CO3的物质的量为0.5 mol,应含有0.5 NA个CO![]() ,0.1 mol OH-含有0.1 mol×10=1 mol e-,故含有NA个电子;1.8 g D2O中含有中子的物质的量为
,0.1 mol OH-含有0.1 mol×10=1 mol e-,故含有NA个电子;1.8 g D2O中含有中子的物质的量为![]() ×10=0.9 mol;标准状况下11.2 L O3中O原子个数为
×10=0.9 mol;标准状况下11.2 L O3中O原子个数为![]() ×NA mol-1×3=1.5 NA。
×NA mol-1×3=1.5 NA。
答案:B
4.解析:MgCl2晶体不能导电,但属于电解质;NaCl溶液能导电,但溶液是混合物,因而不属于电解质;液态氯化氢不导电,但属于电解质;熔融的KOH能导电,属于电解质。
答案:D
5.解析:含氟冰箱中的氟利昂(CF2Cl2)能破坏大气层中的臭氧层,从而形成臭氧空洞。含铅汽油所释放出的铅对人体、环境有害。含磷洗涤剂排出后的水对水体会造成“富营养化”,从而危害水中的生物。 答案:D
6.解析:A.电荷不守恒,错误。 答案:A
7.解析:在质量相等的情况下,物质的摩尔质量越小,所含分子数目越多。在所给四种物质中,NH3的摩尔质量最小,所含分子数目最多。 答案:B
8.解析:先设卤化钾为KX,再列反应方程式求解。
KX+AgNO3====KNO3+AgX↓
39+Mr 108+Mr
15.05 g 21.30 g 解得Mr=127,所以X为I。
答案:D
9.解析:CaSO4微溶于水,应写化学式,所以A不符合。
澄清石灰水应写离子符号,所以B符合。
醋酸应写分子式:CH3COOH,所以C不符合。
NaHCO3完全电离为Na+和HCO![]() ,所以D不符合。答案:B
,所以D不符合。答案:B
10.解析:A组离子无色且相互之间不反应,可能大量共存于无色的同一溶液中;B组离子中的Cu2+在水溶液中为淡蓝色;C组离子中的Mg2+与OH-能反应,不能大量存在于同一溶液中;D组离子中的H+与CH3COO-能反应,不能大量共存于同一溶液中。
答案:A
11.解析:A项制取的HF会腐蚀玻璃,混有SiF4气体;B项可制得纯净HCl;C项制取的HBr及D项制取的HI均能被浓H2SO4氧化而混入SO2气体,故Br2(g)、I2(g)不纯。B正确。 答案:B
12.解析:设Na2S2O3中硫元素的化合价从+2升高到+x,根据化合价升降相等列式得:
![]() =2(x-2)×25.00 mL×10-3 L· mL-1×0.100 mol·L-1
=2(x-2)×25.00 mL×10-3 L· mL-1×0.100 mol·L-1
解得x=6 可知S2O![]() 转化成了SO
转化成了SO![]() 。
答案:D
。
答案:D
13.解析:用固体物质配制溶液的一般步骤为:计算→称量→溶解→转移→洗涤→定容→摇匀。溶解是在烧杯中进行的,溶解后的溶液冷却后才能转移,洗涤后的溶液也应转移到容量瓶中。A.NaOH具有吸湿性和腐蚀性,不能直接放在天平托盘或在纸上称量,应放在玻璃器皿中称量,如小烧杯中;B.固体物质应在烧杯中溶解(NaOH固体溶解时放出大量热);C.NaOH溶解后,应将溶液冷却到室温,再转移到容量瓶中,否则会使结果偏大;D.未经干燥的容量瓶对浓度没有影响。 答案:D
14.解析:加入的Na先与盐酸溶液中的HCl反应,然后再与H2O反应。水是足量的,加入的Na能够反应完全,所以产生的H2一样多。 答案:A
15.解析:①由F2到I2氧化性逐渐减弱。②F2浅黄绿色,Cl2黄绿色,Br2红棕色,I2紫黑色,所以由F2到I2颜色加深。③由F2(g)、Cl2(g)、Br2(l)、I2(s)在常温、常压下的状态可推出单质沸点由F2到I2升高。④还原性HF<HCl<HBr<HI,HI最不稳定,稳定性逐渐减弱。⑤酸性HF<HCl<HBr<HI。⑥半径F-<Cl-<Br-<I-。 答案:C
16.解析:A说法错误,因为O2占有的体积除了与O2的物质的量有关外,还与O2的温度和压强有关;B说法错误,因为22.4 L N2不一定是1 mol;C说法错误,因为在标准状况下水不是气体;D说法正确,因为22 g CO2为0.5 mol,标准状况下的11.2 L HCl也是0.5 mol。 答案:D
17.解析:先求出所配溶液的各种离子的物质的量:
n(NH![]() )=c(NH
)=c(NH![]() )V=0.5 mol·L-1×10 L=5 mol
)V=0.5 mol·L-1×10 L=5 mol
n(K+)=cV=[c(KCl)+2c(K2SO4)]V=(0.16 mol·L-1+2×0.24 mol·L-1)×10 L=6.4 mol
n(Cl-)=c(Cl-)V=[c(NH4Cl)+c(KCl)]V=(0.5 mol·L-1+0.16 mol·L-1)×10 L=6.6 mol
n(SO![]() )=c(SO
)=c(SO![]() )V=0.24 mol·L-1×10 L=2.4 mol因为K+全部由KCl提供,SO
)V=0.24 mol·L-1×10 L=2.4 mol因为K+全部由KCl提供,SO![]() 全部,由(NH4)2SO4提供,所以,n(KCl)=n(K+)=6.4 mol
全部,由(NH4)2SO4提供,所以,n(KCl)=n(K+)=6.4 mol
n〔(NH4)2SO4〕=n(SO![]() )=2.4 mol
)=2.4 mol
n(NH4Cl)=n(Cl-)-n(KCl)=6.6 mol-6.4 mol=0.2 mol 答案:D
18.解析:B.需加热,C.用向上排气法收集,D.收集不到HCl。
答案:A
19.解析:(1)正确的读数方法应是视线与量筒刻度线保持水平,俯视的结果使得量取的液体体积小于计算值,所以配制出的溶液浓度偏低。
(2)药匙上的药品并未称量,洗涤后转移入容量瓶,使得溶质的量增加,所配制的溶液浓度偏高。
(3)定容摇匀后,溶液的配制已经结束,从中任意取出一部分,浓度不会发生改变,所以剩余溶液的浓度不变。
答案:(1)偏低 (2)偏高 (3)不变(或无影响)
20.解析:(1)应该将Ba2+、Cu2+、Ag+除去后再排放。(2)对于Ba2+,可将其转化为难溶且无毒的BaSO4后过滤除去。对于Cu2+、Ag+,可以转化为Cu(OH)2、AgOH后过滤除去,还可回收。此过程中加入的试剂选石灰水而不选烧碱,因为前者价廉易得。用流程图、表格等方法描述处理方案直观简明。
答案:(1)应该将Ba2+、Cu2+、Ag+除去后再排放
(2)
21.解析:铁、铜都会跟Cl2反应(2Fe+3Cl2![]() 2FeCl3,Cu+Cl2
2FeCl3,Cu+Cl2![]() CuCl2),所以不能使用金属燃烧匙做实验。PCl3、PCl5在潮湿空气中生成白雾,Cl2与水反应也产生白雾,它们对观察Cl2与P反应生成白雾现象有干扰作用。第一次通入Cl2要少量,第二次足量,若第一次推多了,则形成PCl5,这对观察白雾冷凝成液滴现象产生干扰。
CuCl2),所以不能使用金属燃烧匙做实验。PCl3、PCl5在潮湿空气中生成白雾,Cl2与水反应也产生白雾,它们对观察Cl2与P反应生成白雾现象有干扰作用。第一次通入Cl2要少量,第二次足量,若第一次推多了,则形成PCl5,这对观察白雾冷凝成液滴现象产生干扰。
答案:(1)避免金属跟Cl2反应,对实验产生干扰
(2)PCl3、PCl5遇水生成白雾,Cl2跟H2O反应生成HCl、HClO,也有雾生成PCl3+3H2O====H3PO3+3HCl Cl2+H2O====HCl+HClO
(3)PCl3+Cl2====PCl5
防止推入过量的Cl2时生成PCl5,观察不到白雾凝成无色液滴的现象
22.答案:①~⑤分别为K2CO3、HBr、CaCl2、AgNO3、NaI。
23.解析:CO2与足量Na2O2反应得到1.6 g气体,即生成O2 1.6 g,也即0.05 mol。
NaHCO3+HCl====NaCl+H2O+CO2↑
2Na2O2+2CO2====2Na2CO3+O2↑
由此得关系式 2NaHCO3 ~ O2
2×0.05 mol 0.05 mol
即NaHCO3为2×0.05 mol=0.1 mol
w (NaHCO3)=![]() ×100%=84%
×100%=84%
答案:小苏打的纯度为84%。
24.解析:(1)n(CO2)=![]() =0.002 mol,故已反应的CaCO3为0.002 mol。样品中生石灰的质量为:5.92 g-0.12 g-0.002 mol×100 g·mol-1=5.60
g,n(CaO)=0.10 mol
=0.002 mol,故已反应的CaCO3为0.002 mol。样品中生石灰的质量为:5.92 g-0.12 g-0.002 mol×100 g·mol-1=5.60
g,n(CaO)=0.10 mol
CaCO3的转化率为:![]() ×100%=98%
×100%=98%
(2)CaCO3 + 2HCl====CaCl2+H2O+CO2↑
0.002 mol 0.004 mol
CaO + 2HCl====CaCl2+H2O
0.10 mol 0.20 mol
c(HCl)=![]() =8.16 mol·L-1
=8.16 mol·L-1
答案:(1)碳酸钙的转化率为98%
(2)盐酸的物质的量浓度为8.16 mol·L-1。