高一化学上学期期末考试卷
满分:100分 考试时间:90分钟
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5
第I卷(选择部分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1、下列各组物质中,均为纯净物的一组是 ( )
A、碘酒、干冰 B、石油、液氯
C、纯碱、苛性钠 D、石灰石、氨水
2、据报道,某些建筑材料会产生放射性同位素氡![]() Rn,从而对人体产生伤害,该同位素原子的中子数和质子数之差是
( )
Rn,从而对人体产生伤害,该同位素原子的中子数和质子数之差是
( )
A.136 B.50 C.86 D.222
3、下列气体不能用浓H2SO4干燥的是 ( )
A.CO2 B.H2S C.SO2 D.HCl
4、下列物质中,不属于电解质的是 ( )
A、NaOH B、蔗糖 C、H2SO4 D、NaCl
5、从碘水中提取碘可以采用的方法是 ( )
A、萃取 B、沉淀 C、蒸馏 D、过滤
6、导致下列现象的主要原因与排放SO2有关的是 ( )
A、酸雨 B、光化学烟雾 C、臭氧空洞 D、温室效应
7、下列物质中常温下既能与NaOH溶液反应,又能与盐酸反应产生氢气是 ( )
A、Mg B、Cl2 C、Si D、Al
8、下列物质只能作还原剂的是 ( )
A、S2- B、Fe2+ C、Fe3+ D、H+
9、下列事故或药品的处理正确的是 ( )
A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B、大量氯气泄漏时,用弱碱浸湿毛巾捂住嘴和鼻,并迅速离开现场
C、不慎洒出的酒精在桌上燃烧起来,应立即用大量水扑灭
D、将含硫酸的废液倒入水槽,用水冲入下水道
10、设NA代表阿伏加德罗常数,下列说法正确的是 ( ) A.2.4克金属镁变成镁离子时失去的电子数目为0.1NA
B.2克氢气所含原子数目为NA
C.在25℃,压强为1.01×105帕时,11.2升氮气所含的原子数目为NA
D.17克氨气所含电子数目为10NA
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
11、下列物品的鉴别方法不正确的是 ( )
A、用焰色反应鉴别NaCl、KCl和Na2SO4
B、用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液
C、利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D、用品红试液鉴别SO2和CO2两种气体
12、制备硅单质时,主要化学反应如下:
(1)SiO2 +2C
![]() Si +2CO↑ (2) Si + 2Cl2
Si +2CO↑ (2) Si + 2Cl2 ![]() SiCl4
SiCl4
(3)SiCl4 + 2H2 ![]() Si + 4HCl
Si + 4HCl
下列对上述三个反应的叙述中,不正确的是 ( )
A、(1)(3)为置换反应 B、(1)(2)(3)均为氧化还原反应
C、(2)为化合反应 D、三个反应的反应物中硅元素均被还原
13、在无色溶液中,下列离子能大量共存的是 ( )
A、Mg2+、SO42-、K +、Cl- B、Na+ 、NH4+ 、NO3-、MnO4-
C、K + 、Cu2+ 、Cl-、Br- D、Ba2+ 、Na+ 、OH-、CO32-
14.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.使红色布条褪色(HCl)
B.将NaHCO3固体加入新制氯水,有无色气泡(H+)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
15、不能通过单质直接化合反应生成的是 ( )
A、Fe3O4 B、FeCl2 C、Na2O2 D、 SO2
16、下列离子方程式书写正确的是 ( )
A、实验室用大理石和稀盐酸制取二氧化碳:2H+ +CO32-=CO2 ↑+H2O
B、铁和稀盐酸反应:2Fe+6H+=3H2 ↑+2Fe3+
C、铜与稀硝酸反应:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
D、铁与FeCl3溶液反应 Fe + Fe3+== 2Fe2+
|
A、制取CuSO4 Cu + 2H2SO4(浓)====CuSO4 + SO2↑+2H2O
B、制取CuSO4 CuO + H2SO4(稀)====CuSO4 + H2O
C、制取FeSO4 FeS + H2SO4(稀)====FeSO4 + H2S↑
D、制取Cu(NO3)2 Cu + 4HNO3(浓)====Cu(NO3)2 +2NO2↑+2H2O
18.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为( )
A.1︰2︰3 B.1︰6︰9 C.1︰3︰3 D.1︰3︰6
19、有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为 ( )
A.1∶4 B.2∶3 C.1∶3 D.4∶1
20、某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是 ( )
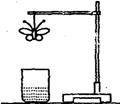
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 蔗糖溶液 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
第II卷(非选择部分)
三、填空题 (本题包括3小题,共24分)
|
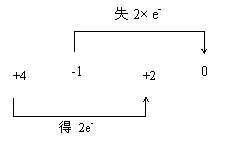
MnO2+4HCl(浓)= MnCl2+ Cl2↑ +2H2O
(1)标出该反应中电子得失的方向和数目。
(2)该反应的氧化剂是: ,还原剂是: 。
(3)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是 mol。
(4)该反应的离子方程式是 。
(5)制备装置再通过装有 、 装置便可得到纯净的氯气。
(6)将产生的Cl2通入KI溶液中,加入CCl4,振荡,下层溶液的颜色是 ;
若将KI改为KBr,加入CCl4,振荡,下层溶液的颜色是 。
22、(8分)等质量的二氧化硫和三氧化硫所含分子数之比是 ,相同条件下的体积比是 ,密度比为 ;如果这两气体分子中所含氧原子数相同,则它们物质的量比为 。
23、(4分)试以盐酸、氢氧化钠为试剂写出验证氧化铝显两性的化学方程式
(1) ;
(2) 。
24、(8分)某学生用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液500mL。
试回答下列问题:
(1)计算所需浓硫酸的体积 (计算结果保留到小数点后1位)。
(2)从下列用品中选出实验所需要的仪器 (填序号)。
A、1000mL烧杯 B、100mL烧杯 C、10mL量筒
D、100mL量筒 E、500mL容量瓶 F、1000mL容量瓶
G、广口瓶 H、托盘天平 I、玻璃棒
除选用上述仪器外,尚缺少的必要仪器是 。
(3)该学生根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④然后将蒸馏水注入容量瓶直至刻度线;⑤把容量瓶盖盖紧,再振荡摇匀。
你认为上述实验中错误的操作是 (用编号表示)。
25、(12分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
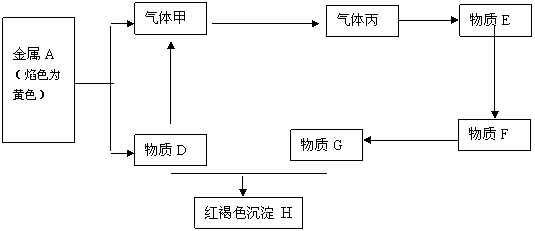 黄绿色气体乙
水
黄绿色气体乙
水
②
水 金属B 金属C
① ③ ④
黄绿色气体乙
⑤
![]()
![]() ⑥
⑥
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、B 、C 、F 、 H 、 乙 。
(2)写出下列反应离子方程式:
反应① 反应⑤ 反应⑥
五、(本题共1小题,共6分)
26、(6分)为测定某碳酸钠样品的纯度,取一定量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况)。计算:
(1)该碳酸钠样品中碳酸钠的质量。
(2)盐酸的物质的量浓度。
![]() 高一化学上学期期末考试卷
高一化学上学期期末考试卷
答 题 卷

第I卷 (选择题共50分)
一、选择题(本题包括10小题,每小题2分,共20分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
二、选择题(本题包括10小题,每小题3分,共30分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
第II卷(非选择题 共50分)
三、填空题 (本题包括3小题,共24分)
21、(12分)
|
(1)MnO2+4HCl(浓)= MnCl2+ Cl2↑ +2H2O
(2)该反应的氧化剂是: ,还原剂是: 。
(3)被氧化的还原剂的物质的量是 mol。
(4) 。
(5) 、 。
(6) ; 。
22、(8分)
, ,
; 。
23、(4分)
(1) ;
(2) 。
四、实验题.( 本题包括2小题,共20分)
24、(8分)
(1) ;
(2) 、 ;
(3) 。
25、(12分)
(1)写出下列物质的化学式:A 、B 、C 、
F 、 H 、 乙 。
(2)写出下列反应离子方程式:
反应① ;
反应⑤ ;
反应⑥ 。
五、(本题共1小题,共6分)
26、(6分)
高一化学上学期期末考试卷
答 案
第I卷 (选择题共50分)
一、 选择题(本题包括10小题,每小题2分,共20分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | B | B | A | A | D | A | B | D |
二、 选择题(本题包括10小题,每小题3分,共30分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | D | A | A | B | C | B | B | B | B |
第II卷(非选择题 共50分)
三、填空题 (本题包括3小题,共24分)
 21、(12分)
21、(12分)
|
(1) MnO2+4HCl(浓)=== MnCl2 + Cl2↑ +2H2O (2分)
(2)该反应的氧化剂是:MnO2 ,还原剂是: HCl 。(各1分)
|
(4) MnO2 +4H+ +2Cl- === Mn2+ + Cl2↑ +2H2O (2分)
(5)饱和食盐水、 浓硫酸 。(各1分)
(6)紫红色、橙红色。(各1分)
22、(8分)
5:4 , 5:4 ,
4:5 ; 3:2 。(各2分)
23、(4分)
(1) Al2O3 +2NaOH ===2NaAlO2 + H2O ;
(2) Al2O3 +6HCl ===2AlCl3 + 3H2O 。(各2分)
四、实验题.( 本题包括2小题,共20分)
24、(8分)
(1) 5.4ml ;
(2) BCEI 、 胶头滴管 ;
(3) ②③④ 。(各2分)
25、(12分)
(1)写出下列物质的化学式:A Na 、B Al 、C Fe 、
F FeCl2 、 H Fe(OH)3 、 乙 Cl2 。(各1分)
(2)写出下列反应离子方程式:
反应① 2Na + 2H2O === 2Na+ + 2OH- + H2↑ ;
反应⑤ 2Fe2+ +Cl2 === 2Fe3+ +2Cl- ;
反应⑥ Fe3+ + 3OH- === Fe(OH)3↓ 。(各2分)
五、(本题共1小题,共6分)
26、(6分)
解:Na2CO3 + 2HCl === 2NaCl + H2O + CO2 ↑----------1分
106g 2mol 22.4L
m(Na2CO3) n(HCl) 0.224L------------1分
m(Na2CO3)==(106g* 0.224L)/ 22.4L==1.06g--------------------1分
n(HCl) ===(2mol * 0.224L)/ 22.4L===0.02mol-------------1分
c(HCl) ===0.02mol / 0.04L == 0.5mol/L-----------------------1分
答:(1)该碳酸钠样品中碳酸钠的质量为1.06g ;
(2)盐酸的物质的量浓度为0.5mol/L。---------------1分