高一化学上学期期末质量评估模拟试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Cu-64
一、选择题(1~15题每小题2分,16~25题每小题3分,共25小题60分,每题仅有一个选项符合题意)
1.据报道,某些建筑材料会产生放射性同位素氡![]() Rn,从而对人体产生伤害该同位素原子的中子数和质子数之差是
( )
Rn,从而对人体产生伤害该同位素原子的中子数和质子数之差是
( )
A.136 B.50 C.86 D.222
2.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
3. 以下实验装置一般不用于分离物质的是 ( )
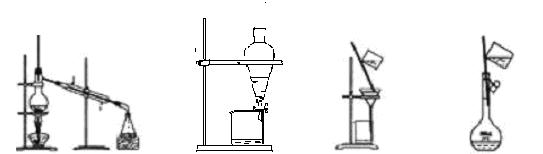
A B C D
4.下列说法错误的是 ( )
A.用KSCN溶液可以检验硫酸亚铁溶液中是否含有铁离子
B.因为碘易溶于酒精,所以常用酒精萃取碘水中的碘
C.用洁净干燥的玻璃棒蘸取溶液,滴在干燥的pH试纸上,跟标准比色卡比较测定溶液的pH
D.用蒸馏的方法可以分离酒精和水的混合物
5.下列反应可用离子方程式:H++OH—=H2O表示的是 ( )
A.硝酸与氨水 B.盐酸与氢氧化钠溶液
C.硫酸与氢氧化钡 D.醋酸与氢氧化钠
6.下列关于物质性质的叙述中,正确的是 ( )
A. Cl2能与金属活动顺序表中大多数金属反应
B. N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C. 硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D. 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应
7.钠与水反应时的现象与钠的下列性质无关的是
A.钠的熔点低 B.钠的密度小 C.钠的硬度小 D.有强还原性
8.下列变化中,不属于化学变化的是 ( )
A.SO2 使品红溶液褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.漂白粉使某些染料褪色
9.下列说法错误的是 ( )
A.稀有气体的原子核外电子排布都是稳定结构
B.让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路”
C.工业上用氮气和氢气合成氨气属于人工固氮过程
D.某气体通入澄清石灰水有白色沉淀产生,该气体一定是CO2
10.下列离子方程式的书写正确的是 ( )
A、实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B、NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O
C、向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- = Al(OH)3↓
D、铁和稀硝酸反应:Fe + 2H+ = Fe 2+ + H 2↑
11.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.标准状况下,2.24 L水中含有0.1 NA个水分子
C.在25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.17g 氨气所含电子数目为10NA
12.下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是 ( )
A.氢氧化钠溶液 B.氯水 C.溴水 D.碘水
13.下列各组中的离子,能在溶液中大量共存的是 ( )
A、 H+ Na+ CO32- Cl- B、 Ba2+ Na+ Cl- SO42-
C、 K+ H+ SO42- OH- D、 Ag+ Al3+ NO3- H+
14.氧化还原反应的本质是 ( )
A.得氧和失氧 B.电子的转移
C.有无新物质生成 D.化合价的升降
15.下列物质是属于非电解质的是 ( )
A、 NH3 B、 (NH4)2SO4 C、Cl2 D、 CH3COOH
16.下列物质间的反应没有明显反应现象的是 ( )
A.常温下,浓硝酸、浓硫酸使铁和铝发生钝化
B.二氧化硫气体分别通入溴水、品红溶液中
C.用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近
D.将氯化氢气体通入滴有酚酞的烧碱溶液中
17.下列说法正确的是 ( )
A.过量的铁粉加入FeCl3、HCl、CuCl2的混合溶液中,充分反应后阳离子主要是Fe3+
B.在海轮的船壳上镶嵌锌块能起到防止钢铁腐蚀的作用
C.光导纤维非常细,导光能力非常强,能同时传输大量信息,光导纤维是由硅晶体制成的
D.硫酸工厂的尾气中,常含有SO2等有害气体,如果直接排入大气,可能形成光化学烟雾
18.同温同压下,两种气体的体积如果不相同,其主要原因是 ( )
A.气体的分子大小不同 B.气体分子间的平均距离不同
C.气体的性质不同 D.气体的物质的量不同
19.在实验室中,对下列事故或药品的处理正确的是 ( )
A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B、金属钠着火燃烧时,用泡沫灭火器灭火
C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D、含硫酸的废液倒入水槽,用水冲入下水道
20.下列有关物质检验的说法正确的是 ( )
A.MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
B.(NH4)2SO4、K2SO4、NH4C1三种物质不能用一种试剂通过化学反应区别开
C.可以用BaCl2溶液和稀硝酸检验Na2SO3 是否变质
D.用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气
21.下列各组中的物质如果敞口放置都会变质的是 ( )
A. 漂白粉、绿矾、石灰石、铝条 B. 氯水、氢氧化钠、重晶石、水玻璃
C. 无水硫酸铜 、亚硫酸钠、氧化钠、石灰水 D. 浓硝酸、钠、浓硫酸、碳酸氢钠
22.C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:![]()
下列说法中正确的是 ( )
A.KClO3在反应中是还原剂
B.1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C.在反应中H2C2O4既不是氧化剂也不是还原剂
D.1 mol KClO3参加反应有1 mol电子转移
23.用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是( )
A.在烧杯中溶解时,有少量液体溅出 B.样品中含有少量Na2O杂质
C.容量瓶使用前未干 D.定容时仰视容量瓶刻度线
24.关于盐酸、硫酸、硝酸的说法正确的是 ( )
A、都是含氧酸 B、都属于强电解质
C、都容易挥发 D、都能与金属Mg发生反应产生气体
25.下列溶液氯离子的物质的量浓度与50mL 1 mol·L-1氯化铝溶液中氯离子的物质的量浓度相等的是 ( )
A、150 mL 1 mol·L-1氯化钠溶液 B、75 mL 2 mol·L-1氯化铵溶液
C、150 mL 3 mol·L-1氯化钾溶液 D、50 mL 3 mol·L-1氯化亚铁溶液
二、填空题(本题包括3小题,共27分)
26.(6分)工业上生产玻璃、水泥和炼铁都要用到的原料是 。氯碱工业制取氯气等产品的化学方程式是 。接触法制备硫酸的主要设备有 、 、 。
27. (8分)(1)0.5mol H2O的质量为____________,其中含有_________个水分子,______个电子,氢原子的物质的量为__________,
28.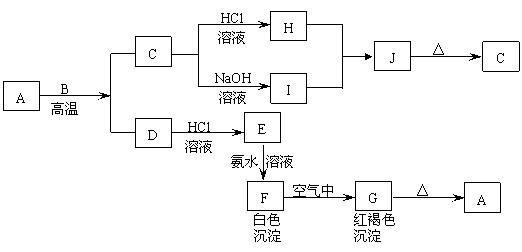 (13分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(13分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学式:
A: E: J: G:
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:
F在空气中转化为G的化学方程式:
C转化为I的离子方程式:
三、实验题(本题共2小题,共19分)
29.(8分)实验室配制500 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转入500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度2~3厘米处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号) 。
(2)本实验两次用到的基本仪器是 。
(3)若出现如下情况,对所配溶液浓度将有何影响?没有进行操作④ (偏高,偏低或不变)。
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
30、(11分)为了探究铁与氯气的反应,某同学甲设计了如下的实验方案。
其实验装置为:
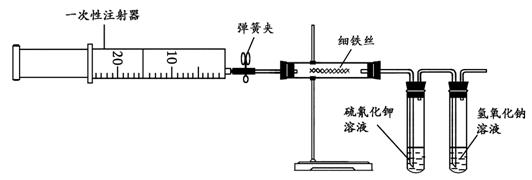
其实验步骤为:
(1)用注射器吸取20 mL左右的氯气。
(2)在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。
(3)加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。可观察到的主要现象是 。
(4)请写出试管中所发生反应的离子方程式: ,
。其中,氢氧化钠溶液的作用是 。
四、计算题(本题包括22、23两小题,共14分)
31.(6分)已知在标准状况下,1L水中约能溶解700L的氨气,所得氨水溶液的密度为0.9g·cm-3,求饱和氨水的物质的量浓度。
32.(8分)在250mL 某混合溶液中,HNO3和H2SO4物质的量浓度分别为0.2mol·L-1‑和0.1mol·L-1 。向该混合溶液中加入1.92g 铜粉,加热充分反应。
(1)写出该反应的离子方程式__________________________________________。
(2)计算所得溶液中Cu2+ 的物质的量浓度。
参考答案
一、选择题(1~15题每小题2分,16~25题每小题3分,共25小题60分,每题仅有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| B | A | D | B | B | A | C | C | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | D | A | D | B | A | A | B | D |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | ||
| A | D | C | D | B | D | C |
二、填空题(本题包括3小题,共27分)
26.石灰石、2NaCl+2H2O![]() 2NaOH
+H2↑+Cl2↑、沸腾炉、接触室、吸收塔
2NaOH
+H2↑+Cl2↑、沸腾炉、接触室、吸收塔
27.9g、3.01×1023、3.01×1024、1mol
28.(1)Fe2O3、FeCl2、Al(OH)3、Fe(OH)3
(2)2Al + Fe2O3![]() 2Fe
+Al2O3、4Fe(OH)2 +O2 +2H2O
=4Fe(OH)3、Al2O3 +2OH-=AlO2-+H2O
2Fe
+Al2O3、4Fe(OH)2 +O2 +2H2O
=4Fe(OH)3、Al2O3 +2OH-=AlO2-+H2O
三、实验题(本题共2小题,共19分)
29.①②④③⑤、玻璃棒、偏低、重新配配制
30.铁丝剧烈燃烧、保持红热,产生棕褐色的烟,盛硫氰化钾溶液的试管内显红色
Fe3++3SCN-= Fe(SCN)3 Cl2+2OH-=Cl-+ClO-+H2O 吸收尾气Cl2
四、计算题(本题包括22、23两小题,共14分)
31.18.4mol·L-1
32.3Cu +8H+ + 2NO3- =3Cu2+ +2NO↑+4H2O、0.12mol·L-1