高一年级化学第一学期阶段性测试试卷
学科
考试时间:100分钟 总分:120分 命题:赖军
(第I卷 选择题共62分)
可能用到的原子量:H—1 O—16 Na—23 Mg—24
一、选择题(本题包括10小题,每小题只有一个答案符合题意,共30分)
1、从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于
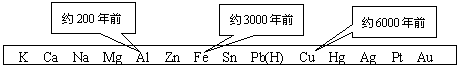 |
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
2、镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤, 滤液中存在的离子有
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
3、下列关于Na和Na+的叙述中,错误的是
A.它们相差一个电子层 B.它们的化学性质相似
C.单质钠可保存在煤油中 D.灼烧时,它们的焰色反应都呈黄色
4、下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
5、现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,只用一种试剂就能够将它们区别开,这种试剂是
A.氨水 B.AgNO3 C.浓NaOH D.NaCl
6、在酸性溶液中,能大量共存的离子是
A.Mg2+、Fe3+、NO3-、SCN- B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3- D.Na+、Ba2+、NO3-、SO42-
7、实验室中,加入过量的下列试剂,可使AlCl3溶液中的Al3+全部沉淀出来的是
A.NaOH溶液 B.AgNO3溶液 C.盐酸 D.氨水
8、下列反应,其产物按红、红褐、淡黄的顺序排列的是
①金属钠在纯氧气中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液
A.②③① B.③②① C.③①② D.①②③
9、已知钡的活动性处于钾和钠之间,下列说法正确的是
A.在溶液中钡离子可氧化Zn B.钡可以从NaCl溶液中置换出Na
C.钡可以从冷水中置换出H2 D.钡可以从CuCl2溶液中置换出Cu
10、某物质燃烧时,焰色为黄色,下列判断正确的是
A.该物质一定为钠盐 B.该物质一定不含有钾元素
C.该物质一定是金属钠 D.该物质中一定含有钠元素
二、选择题(本题包括8小题,每小题有一到两个答案符合题意,共32分)
11、在甲、乙、丙、丁四个烧杯中分别放入0.1mol的钠、氧化钠、过氧化钠、氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数由大到小的顺序是
A.甲<乙<丙<丁 B.丁<甲<乙=丙 C.甲=丁<乙=丙 D.丁<甲<乙<丙
12、有两瓶失去标签的物质的量浓度相同的Na2CO3和NaHCO3稀溶液。下列鉴别方法和所得到的结论不正确的是
A.取少量未知溶液,分别滴加Ba(NO3)2溶液,有沉淀的为Na2CO3溶液
B.取少量未知溶液,分别滴加CaCl2溶液,有沉淀的为Na2CO3溶液
C.分别滴加酚酞试液,红色较深的是Na2CO3溶液
D.用pH试纸测定两溶液的pH,pH小的为Na2CO3溶液
13、下列离子方程式中书写正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓
C.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+2CO2=Ca(HCO3)2
14、向明矾溶液中滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀 D.几乎全部以AlO2-形式存在于溶液中
15、将Na2O2投入FeCl3溶液中, 可观察到的现象是
A.生成白色沉淀 B.生成红褐色沉淀 C.有气泡产生 D.无变化
16、有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成不可能是
A.Fe、Zn B.Al、Cu C.Cu、Mg D.Al、Fe
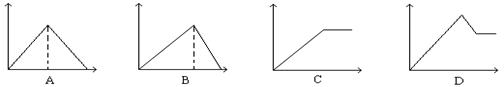
17、向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) D
18、向两烧杯中分别加入等足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A 1︰2 B 3︰2
C 3︰1 D 6︰1
(第Ⅱ卷 非选择题 共58分)
三、(本题共3个小题,共24分)
19、(6分)实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种试剂一次鉴别它们。甲同学选的是一种正盐溶液,乙同学选的是一种有色试剂,他们都得到了正确结论。试推断甲、乙两位同学选用的试剂:
甲 __________ ,乙 _________ 。还可以用__________。(均填名称)
碳酸钠 紫色石蕊 碳酸氢钠(其他合理答案也可以)
20、(10分)A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,B的溶液中阴离子只有一种,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。试推断写出各物质得化学式:
A:__________ B:___________ C:___________ D:___________ E:_________。
A:Na2CO3 B:KOH C:NaHCO3 D:NaCl E:Fe(OH)3。
21、(8分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
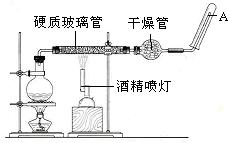
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(3)酒精灯和酒精喷灯点燃的顺序是 ,为什么? 。
(每空1分,化学方程式2分).(1)![]() ;Fe;H2O
;Fe;H2O
(2)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止爆沸。
(3)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应。
四、(本题包括2小题,共18分)
22、(8分)物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽。请在下面金属用途后的横线上填上金属性质对应的序号。
(1)用铝定制成包装用的铝箔 ;
(2)用铝制成的高压铝锅 ;
(3)用铁粉回收照相业废液中的银 ;
(4)电信业中大量使用的铜丝、金属电缆 。
⑴④ ⑵① ⑶③ ⑷②④
23、(10分)下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质,B、C为氧化物。(反应过程中生成的水及其他产物已略去)
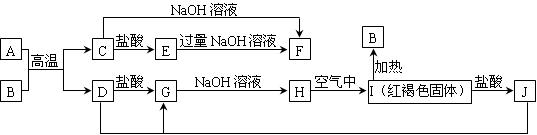
请回答以下问题:
(1)B是__________,H是_______________。(填化学式)
(2)H在空气中能够转化为I,写出此过程的化学反应方程式:
________________________________________________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的离子方程式
_______________________________________________________________________。
(4)写出J与D反应转化为G的离子方程式_________________________________。
(1)Fe2O3,Fe(OH)2
(2)4 Fe(OH)2+O2+2H2O=4 Fe(OH)3
(3)2Al+2OH—+2H2O=2 AlO2—+3 H2↑
(4)2 Fe3++ Fe=3 Fe2+
五、计算题(本题共2小题,共16分)
24、(6分)将70g过氧化钠和氧化钠的混合物跟98g水充分反应后,所得氢氧化钠溶液的质量分数为50%。计算原混合物中过氧化钠和氧化钠的质量各为多少?
m(Na2O2)=39g,m(Na2O)=31g
25、25、(8分)将一定量的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。若在滴加NaOH溶液的过程中,产生的沉淀质量m随加入NaOH溶液的体积V变化如下图所示,请回答:
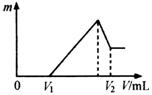
(1)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)400mL。
(2)V2等于440mL时,沉淀的质量m等于3.48g,求n(Mg)=0.06mol,n(Al)=0.04mol。
(3)V1的值是160mL。