高一年级化学第三次阶段检测
化 学 试 卷
满分:100分 时间:60分钟 命题:钱宏先
可能用到的相对原子质量:
H:1 C:12 O:16 N:14 Cl:35.5 Na:23 Mg:24 Al:27
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素表示为 ( )
A.![]() He B.
He B.![]() He C.
He C.![]() He D.
He D.![]() He
He
2、气体的体积主要由以下什么因素决定的:
①气体分子的直径 ②气体物质量的的多少 ③气体分子间的平均距离
④气体分子的相对分子质量 ( )
A.①② B.①③ C.②③ D.②④
3、钠长时间放在空气中,最后的产物主要成分是 ( )
A、Na2O B、NaOH C、Na2CO3 D、Na2CO3·10 H2O
4、物质灼烧时,透过蓝色钴玻璃火焰呈紫色的一定含有 ( )
A、钾原子 B、钾离子 C、钾元素 D、钾的化合物
5、鉴别苏打和小苏打的稀溶液的最好的试剂是 ( )
A、氯化钙溶液 B、氢氧化钠溶液 C、澄清石灰水 D、CO2
6、地壳中含量最多的金属元素是 ( )
A、O B、Si C、Al D、Fe
7、将同一盐酸滴加到相同浓度的Na2CO3和NaHCO3溶液中,二者均释放出CO2,两个反应的剧烈程度 ( )
A.与Na2CO3反应剧烈 B.与NaHCO3反应剧烈
C.二都的反应一样剧烈 D.无法判断二者反应的剧烈程度
8、将等质量的两份铝分别与足量的稀盐酸和氢氧化钠溶液反应,产生气体在相同条件的体积比为 ( )
A、1:1 B、2:1 C、3:1 D、1:3
二、选择题(本题包括8小题,每小题4分,共32分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
9、需要加入还原剂才能实现的变化是 ( )
A.MnO2→MnO![]() B、CO2→H2CO3 C.Fe3+→Fe2+
D.Cl2→Cl-
B、CO2→H2CO3 C.Fe3+→Fe2+
D.Cl2→Cl-
10、NA表示阿伏加德罗常数下列说法错误的是 ( )
A.1 mol H2O和1 mol NH3所含电子数均为10 NA
B.2L 0.5 mol /LCH3COOH溶液中含有的CH3COO-数目为NA
C.100mL 0.1 mol/LAl2(SO4)3 溶液中Al3+的浓度为0.2mol/L
D.用电解Al2O3法制取5.4g铝时转移的电子数为1.2NA
11、在无色透明的溶液中能大量共存的是 ( )
A、Cu2+ Cl- SO42- K+ B、AlO2- SO42- K+ Cl-
C、H+ CH3COO— Ca2+ Cl- D、NH4+ OH- Cl- Na+.
12、能使湿润的淀粉KI试纸变蓝的是 ( )
①溴水 ②氯水 ③碘酒 ④氯化钾 ⑤AgNO3溶液
A.①②③ B.①⑤ C.①②③⑤ D.③④⑤
13、下列离子方程式中,书正正确的是 ( )
A.钠与水反应: Na+2H2O===Na++2OH-+H2↑
B.氧化铝与盐酸:O2-+2H+===H2O
C.NaOH溶液与小苏打溶液反应:HCO3-+OH-===CO32-+H2O
D.氯气通入水中:Cl2+H2O![]() H+ +Cl-+ClO-
H+ +Cl-+ClO-
14、对于某些离子的检验及结论一定正确的是 ( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+
15、下列说法正确的是 ( )
A.难溶于水的电解质不一定是弱电解质
B.强电解质在水溶液导电能力一定比弱电解质的水溶液强
 C.电解质在通电情况下电离成阴、阳离子
C.电解质在通电情况下电离成阴、阳离子
D.强电解质在水溶液里全部电离成阴、阳离子
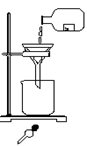
16、某学生发现滴瓶中溶液里有悬浊物,
拟用右图所示操作进行过滤,错误的操作有( )
A.4处 B.3处 C.2处 D.1处
第一、二题选择题(共56分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
三、填空题(35分)
17、(3分)将相同质量的镁条分别放在①O2中、②N2中、③空气中、④CO2中燃烧,将燃烧后所得固体的质量按由小到大排列的顺序是 。
18、(12分)用双线桥标出下列反应中的电子转移的方向及数目:
3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
(1)标出电子转移情况后的化学方程式为:
。
(2)该反应中的还原剂是 ,还原产物是 ,被还原的硝酸与未被还原的硝酸的质量比为 。
(3)把该反应的化学方程式改写为离子方程式:
。
19、(20分)已知下图中,A、D、G三种物质都能与强酸强碱反应,B为红棕色固体。根据图示回答以下问题:
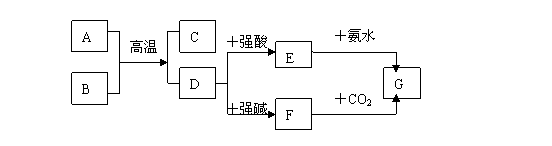

(1)写出化学式:A B D G
(2 ) 写出A+B=C+D的化学反应方程式
(3 ) 写出D→F ,E→G,F→G的离子反应方程式
D→F
E→G
F→G
四、计算题(9分)
20、将4.6g钠投入100ml 1mol/L的AlCl3 溶液中充分反应后,求溶液中铝元素质量。
江苏省泗阳中学高一年级第三次阶段检测
化学试卷答案
第一、二题选择题(共56分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | C | C | A | C | B | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | BD | B | A | C | C | AD | A |
三、填空题(35分)
17、(3分) ②<③<①<④。
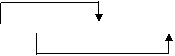 18、⑴(3分) 失2e—×3
18、⑴(3分) 失2e—×3
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
得3e—×2
⑵(6分) Cu NO 1:3
⑶(3分)3Cu+8H++2NO3—==3Cu2++2NO↑+4H2O
|
(2 ) (3分)2Al+Fe2O3====Al2O3+2Fe
(3 ) (9分)D→F:Al2O3+2OH—====2AlO2—+H2O
E→G:Al3++3NH3-H2O====Al(OH)3↓+3NH4+
F→G:AlO2—+CO2+2H2O====Al(OH)3↓+HCO3—
或2AlO2+CO2+3H2O====2Al(OH)3↓+CO32—
四、计算题(9分)
20、解:由题意知:n(Na)=![]() =0.2 mol…………………………………1分
=0.2 mol…………………………………1分
n(AlCl3)=0.1l×1mol/l=0.1mol…………………………………………………1分
∵2Na+2H2O===2NaOH+3H2↑
2mol 2mol
0.2mol 0.2mol……………………………………………………………2分
又∵Al3+ + 3OH—=Al(OH)3↓
1mol 3mol
0.1mol 0.3mol>0.2mol………………………………………………………2分
∴反应后溶液中还含有:n(Al3+)=0.1mol-![]() ×0.2mol=
×0.2mol=![]() mol…………………2分
mol…………………2分
即溶液中铝元素的质量为:m(Al3+)=![]() mol×27g/mol=0.9 g…………………1
mol×27g/mol=0.9 g…………………1