高一年级化学第二次阶段测试()
第一卷(选择题 共50分)
可能用到的原子量:H—1 O—16 Na—23 Mg—24 Zn—65 S--32
一、选择题(本题包括10小题,每小题2分,共20分。每小题有一个符合题意)
1、从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于
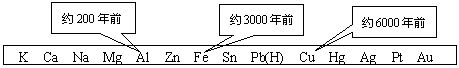 |
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
2.化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提。下列实验操作正确的是
A.过滤时,漏斗的下端应紧贴烧杯内壁
B.给试管中的液体加热时,可以用手直接拿试管
C.蒸馏液体时,冷水应从冷凝管的上端进入
D.分液时,分液漏斗中的上层液体也可从漏斗下端流出
3、现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,只用一种试剂就能够将它们区别开,这种试剂是
A.氨水 B.AgNO3 C.浓NaOH D.NaCl
4、在酸性溶液中,能大量共存的离子是
A.Mg2+、Fe2+、NO3-、Cl- B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3- D.Na+、Ba2+、NO3-、SO42-
5、实验室中,加入过量的下列试剂,可使AlCl3溶液中的Al3+全部沉淀出来的是
A.NaOH溶液 B.AgNO3溶液 C.盐酸 D.氨水
6、下列反应,其产物按红、红褐、淡黄的顺序排列的是
①金属钠在纯氧气中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液
A.②③① B.③②① C.③①② D.①②③
7、已知钡的活动性处于钾和钠之间,下列说法正确的是
A.在溶液中钡离子可氧化Zn B.钡可以从NaCl溶液中置换出Na
C.钡可以从冷水中置换出H2 D.钡可以从CuCl2溶液中置换出Cu
8、下列离子方程式中书写正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-=H2O+BaSO4↓
C.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+2CO2=Ca(HCO3)2
9、下列对溶液、胶体和浊液的认识正确的是
A.三种分散系的分散质均能通过滤纸
B.胶体在一定的条件下也能稳定存在
C.溶液和胶体通常都是无色透明的液体,而浊液不透明
D.胶体区别于其他分散系的本质特征是产生丁达尔现象
10、向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) D
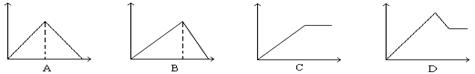
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11、向两烧杯中分别加入等足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A 1︰2 B 3︰2 C 3︰1 D 6︰1
12.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中发生的变化不属于氧化还原反应的是
A.食物长时间放置后变质腐败 B.燃烧液化石油气为炒菜提供热量
C.用活性炭除去冰箱中的异味 D.烧菜用过的铁锅出现红棕色斑迹
13.将Na2O2投入FeCl3溶液中, 可观察到的现象是
A.生成白色沉淀 B.生成红褐色沉淀 C.有气泡产生 D.无变化
14.化学与生活密切相关。下列情况会对人体健康造成较大危害的是
A.用Cl2对自来水进行消毒杀菌
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D.用小苏打(NaHCO3)发酵面团制作馒头
15.下列叙述正确的是
A.常温常压下,5.6 L NH3的物质的量为0.25 mol
B.0.5 mol H2的质量为1 g,体积为11.2 L
C.40 g NaOH溶于1 L水中,得到的溶液物质的量浓度为l mol·L-1
D.9 g H2O中氧原子数与8 g O2中氧原子数相等
16.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一。铝及其化合物在下列场合的使用须加以控制的是:① 制铝锭,② 制易拉罐,③ 制电线、电缆,④ 制包糖果用的铝箔,⑤ 用明矾净水,⑥ 制炊具,⑦ 用明矾作食物膨胀剂,⑧ 用氢氧化铝制胃药,⑨ 制防锈油漆。
A.②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧⑨
C.①②④⑤⑦⑧ D.③④⑤⑥⑦⑧
17.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。
a和b分别是
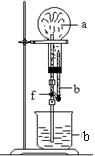 |
| 选项 | a(干燥气体) | b(液体) |
| A | NO2 | 水 |
| B | CO2 | 4 mol·L-1NaOH溶液 |
| C | C12 | 饱和食盐水 |
| D | NH3 | l mol·L-1盐酸 |
18.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取
单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原制得:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………①
Sb4O6+6C=4Sb+6CO ………………………………②
关于反应①、反应②的说法正确的是
A. 反应①中的氧化剂是Sb2O3 ,反应②中的氧化剂是Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol 电子
C.反应②中Sb的化合价由+6降为0
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
19.某溶液有如下性质:① 溶液显强碱性;② 加入足量的稀盐酸能产生使澄清石灰水变浑浊的气体;③ 加入Ba(NO3)2溶液后产生白色沉淀。该溶液中一定能大量存在的离子有
A.Na+、SO32-、CO32- B.NH4+、SO42-、HCO3-、Fe2+
C.K+、OH-、CO32- D.H+、Al3+、NO3-、AlO2-
20.将CuO和Fe粉的混合物加入少量的稀硫酸和硫酸铁的混合溶液后微热,反应停止后有固体剩余,滤出固体不溶物,再向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,判断下列结论中正确的是
A.固体不溶物一定是Cu
B.固体不溶物一定是Fe
C.固体不溶物一定含有Cu,可能含有Fe
D.滤液中一定含有Fe2+,一定不含有Fe3+、Cu2+
第二卷(非选择题 共50分)
三、(本题包括2小题,共16分)
21.(6分)实验室需配制4.6 mol·L-1的H2SO4溶液0.5 L。
⑴ 需要浓度为18.4 mol·L-1的浓硫酸 mL;
⑵ 需要用的玻璃仪器除玻璃棒、量筒外还有 ;
⑶ 配制过程中因溶质损耗而导致溶液浓度偏低的错误操作是 。
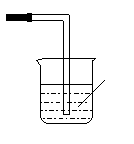
22.(10分)某研究性学习小组的同学对Cl2使有色物质褪色的机理进行了探究。
甲同学设计了如下图所示的实验装置并进行实验:
![]()
![]()
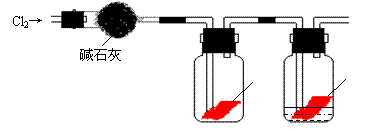
⑴ 甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因 ;
⑵ 甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是 ,由此得出Cl2使有色物质褪色的机理是 ;
⑶ 乙同学认为甲设计的实验装置即使改进后还缺少一部分。请你将乙认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂的名称。
⑷ 请你写出Cl2和“③”中“最合适的化学试剂”反应的离子方程式 。
四、(本题包括2小题,共17分)
23.(7分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
⑴ 硅是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。
⑵ 大量使用化石燃料的最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。请你举出两种防治酸雨的措施 、 。
⑶实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种试剂一次鉴别它们。甲同学选的是一种正盐溶液,乙同学选的是一种有色试剂,他们都得到了正确结论。试推断甲、乙两位同学选用的试剂:
甲 __________ ,乙 _________ 。还可以用__________。(均填名称)
24.(10分)(1)SiO2的_________结构决定了它有优良的物理化学性质.
(2)明矾化学式_________
(3)溴单质,溴离子,碘单质,碘离子同时加到同一烧杯中的离子方程式_________
(4)课本上出现的可逆反应一个是二氧化硫溶于水,还有两个工业应用广泛的方程式为_________
五、(本题包括1小题,共10分)
25.(10分)硫酸和硝酸是工业上具有重要用途的强酸。目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸。下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出)。
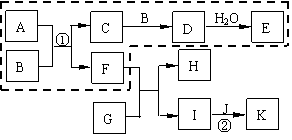
已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸。J是日常生活中用途最多的、但在下列⑴、⑵两种情况中不同的金属单质。
依据上述信息,回答下列问题:
⑴ 若E的相对分子质量比D大17,G是一种活泼金属单质,则:
① 反应①的化学方程式为 ;
② 反应②的离子方程式为 。
⑵ 若E的相对分子质量比D大18,I是一种盐,反应②是化合反应,且A、F、I、J、K中含有同一种金属元素,则:
① A的组成元素为 ;
②反应②的离子方程式为 。
六、(本题包括1小题,共7分)
26.(7分)把19.2 g 的Cu放入足量的稀硝酸中,微热至Cu完全反应。求:
⑴ 19.2 g Cu的物质的量;
⑵ 参加反应的硝酸的物质的量;
⑶ 生成的NO在标准状况下的体积。
化学月二答案
选择题
1-5 D A C B D 6-10 B C C B D
11-15 B C BC B D 16-20 A BD B AC CD
三、(本题包括2小题,共16分)
21.(6分,每空2分)
⑴ 125.0
⑵ 500mL容量瓶、烧杯、胶头滴管
⑶ 移液时未充分洗涤烧杯和玻棒(或移液时未用玻棒引流而使少量液体外溢)
![]()
 22.(10分,每空2分)
22.(10分,每空2分)
⑴ 使用的干燥剂碱石灰将Cl2吸收
⑵ 干燥的有色布条不褪色,湿润的有色布条褪色
Cl2和水反应生成次氯酸,次氯酸具有漂白作用
⑶ (如图)
⑷ Cl2+2OH-=Cl-+ClO-+H2O
四、(本题包括2小题,共14分)
23.(8分,每空1分)
⑴ 玻璃、水泥、混凝土、陶瓷、光导纤维等
⑵ 推广原煤脱硫技术、改进燃烧技术,减少燃煤过程中SO2等废气的排放、推煤燃烧后的烟气脱硫、调整能源结构,发展和使用清洁能源、加强环境管理,强化环保执法,严格控制SO2的排放量等
(3)碳酸钠 紫色石蕊 碳酸氢钠(其他合理答案也可以)
五、(本题包括2小题,共18分)
25.(10分,每空2分)
![]()
⑴ ① 4NH3+5O2 4NO+6H2O
② 2Al+2OH-+2H2O=2AlO2-+3H2↑
⑵ ① S
②2Fe3++Fe=3Fe2+
解: ⑴ n(Cu)=![]() =0.3 mol ……………………………………………………(2分)
=0.3 mol ……………………………………………………(2分)
⑵ 3Cu + 8HNO3=3Cu(NO3)2+2NO↑+4H2O…………………………(1分)
3 8
0.3 mol n(HNO3)
![]()
n(HNO3)=0.8 mol ………………………………………………(2分)
⑶ 3Cu +8HNO3=3Cu(NO3)2+ 2NO↑ +4H2O
3mol 44.8L
0.3 mol V(NO)
![]()
V(NO)=4.48 L ………………………………………………(2分)
答:⑴ 19.2 g Cu的物质的量为0.3 mol;
⑵ 参加反应的硝酸的物质的量为0.8 mol;
⑶ 生成的NO在标准状况下的体积为4.48L。