高一第二学期期中考试化学试题(选修)
命题人:嵇友路 审校:包肄玖 考试时间:100分钟 总分:120分
可能用到的相对原子质量:
H—1 C—12 O—16 Na—23 S—32 Ca—40 Cl—35.5
注意:请将试卷答案填入答题纸上,写在其他地方一律不得分。
第I卷(选择题 共48分)
一、选择题(本题包括8小题,每小题3分。每小题只有一个选项符合题意)
1.18世纪初,德国青年化学家乌勒首次在世界上成功地从一种无机物制得了有机物——尿素[CO(NH2)2],此无机物是尿素的同分异构体。此无机物是
A.(NH4)2CO3 B.NH4CN
C. NH4CNO D.NH4NO3
2.下列说法中错误的是 ( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
3.Na和Na+两种微粒中,不相同的是 ( )
①核内质子数②核外电子数③最外层电子数④核外电子层数
A ①② B ②③ C ③④ D ②③④
4.下列反应属于吸热反应的是 ( )
A.稀硫酸和氢氧化钾溶液反应 B.一氧化碳还原氧化铜的反应
C.锌与稀硫酸的反应 D.生石灰变成熟石灰的反应
5.与OH-具有相同质子数和电子数的粒子是: ( )
A.F-
B.Cl-
C.NH3
D.NH![]()
6.氢氧化钠与盐酸的反应属于 ( )。
A.吸热反应 B.放热反应
C.既是吸热反应也是放热反应 D.都不是
7.在常温下,把一个盛有一定量甲烷和氯气的密闭容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是 ( )
A.容器内原子总数不变 B.容器内分子总数不变
C.容器内压强不变 D.发生的反应属于取代反应
8.元素的性质随着原子序数的递增呈现周期性变化的根本原因是:( )
A.元素相对原子质量的递增而引起的变化
B.元素的化合价呈周期性的变化
C.元素原子核外电子排布呈周期性的变化
D.元素的金属性和非金属性呈周期性变化
二、选择题(本题包括8小题,每小题3分。每小题有一个或两个选项符合题意。若某小题有两个选项符合题意,只选一个且正确得2分,只要有错该小题则为0分)
9.决定化学反应速率的主要因素是: ( )
A.催化剂 B.参加反应的物质的性质 C.温度 D.压强
10.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解质溶液和空气,则下列叙述正确的是 ( )
A.锌为正极,空气进入负极反应 B.负极反应为:Zn-2![]() -=Zn2+
-=Zn2+
C.正极发生氧化反应 D.电解质溶液肯定不是强酸
11.以M原子为中心形成的MX2Y2分子中,X、Y分别只以单键与M相结合,下列说法正确的是 ( )
A.若MX2Y2分子构型为平面四边形,则无同分异构体
B.若MX2Y2分子构型为平面四边形,则有两种同分异构体
C.若MX2Y2分子构型为四面体型,则无同分异构体
D.若MX2Y2分子构型为四面体型,则有两种同分异构体
12.反应A+3B=2C+D在四种不同情况下的反应速率分别为 ( )
①v(A)=0.15mol/(L·S) ②v (B)=0.6mol/(L·S)
③v (C)=0.4mol/(L·S) ④v (D) =0.45mol/(L·S)
则反应进行的快慢顺序为 ( )
A. ④>③>②>① B. ②>④>③>①
C. ③=②>④>① D. ④>③=②>①
13.元素周期表中某区域的一些元素多能用于制半导体,它们是( )
A.左、下方区域的金属元素
B.金属元素和非金属元素分界线附近的元素
C.右、上方区域的非金属元素
D.稀有气体元素
14.已知反应X+Y=M+N为放热反应,对该反应的说法正确的是: ( )
A.X的能量一定高于M
B.X和Y的总能量一定高于M和N的总能量
C.X和Y的总能量一定低于M和N的总能量
D.因为该反应为放热反应,故不必加热就能发生
15.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为: ( )
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
16.取一定量的甲烷与少量氧气混合点燃,生成CO、CO2和水蒸气的混合物49.6g,将燃烧后的混合物缓缓通过无水氯化钙并吸收完全,氯化钙的质量增加25.2g,由此可知甲烷不完全燃烧所得产物中一氧化碳的质量是( )
A. 11.2g B.8.4g C.5.6g D.28g
第II卷(非选择题 共72分)
三、实验题(共18分)
17.在一个小烧杯里,加入20gBa(OH)2·8H2O粉末,将小烧杯放在事先已滴有3滴~4滴水的玻璃片上。然后加入10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是 。
(2)写出有关反应的方程式: ,该反应
属 反应。(填四种基本反应类型)。
(3)实验中观察到的现象有 、 通过 现象,说明该反应为 热反应,这是由于反应的总能量 生成物的总能量。
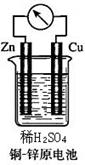 18.如右图所示的铜-锌原电池中,
18.如右图所示的铜-锌原电池中,
(1)理论上应观察到的现象是:
铜片上:
锌片上:
(2)此时原电池的电极反应式是:
正极:
负极:
(3)但在实际实验中,锌片上也有 、表面变黑等现象,其原因是 。
在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率 (选填“要快”、“要慢”、“相等”、“无法确定”)
四、填空题(包括两小题,共21分)
19.火力发电是通过化石燃料燃烧,产生的热量使水气化为蒸汽,推动蒸汽轮机,然后带动发电机发电。从能量转换角度看,火力发电的系列能量转换过程是:
能→ 能→ 能→ 能。
现在有一种最有发展前景的新型电池——燃料电池,它相对于火力发电主要有两个优点:① ②
相对于一般电池,燃料电池的最大优点是 z
20.有X、Y、Z三种元素,其中Y、Z为短周期元素,;X元素在周期表的第五周期,X的负一价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol。在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色。试回答:
(1)元素符号:X________,Y_________,Z__________。
(2)Y的两种氧化物为____________和___________。
写出此两种氧化物与水反应的化学方程式___________;__________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为___________________。
(4)写出Y和Z形成的化合物的电子式:___________;
Z单质分子的电子式:__________
五、推断题(包括3小题,共21分)
21.在一定条件下,RO3n-和I-发生离子反应如下:RO3n-+6I-+6H+==R-+3I2+3H2O。
(1)上式中,n=_________。
(2)在RO3n-中R元素的化合价是________;
(3)R元素的原子最外层电子数是__________。
22.(1)在NaCl、NaOH、Na2O2、N2、H2S、H2O2中, 只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又含有极性键的是 ,既含有离子键又含有非极性键的是
(2) 用电子式表示下列物质的形成过程:
MgCl2 ________________________________________
H2O___________________________________________
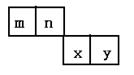
23.m、n、x、y四种短周期元素在周期表里的相对位置如下图所示。
|
(1)元素n的气态氢化物的电子式为
(2)m与Y所形成的化合物含 (填极性 非极性)键。
(3)x的原子结构示意简图为
(4)由n、y的氢化物相互作用所生成的物质的电子式为
六、计算题(共12分)
24.在1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温(450℃)下30min后达到平衡。
(1)若得到0.06molSO3,求SO2的转化率(即已反应的占起始总物质的量的百分比);
(2)求30min内的平均反应速率:v(SO3)、v(O2)、v(SO2)。
(3)求平衡时气体压强与开始时气体压强之比。