高一化学微观结构与物质的多样性测试
说明:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间60分钟。
2. 请将全部答案填到答题卷中。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27
|
在下列各题的四个选项中均只有一个是符合题目要求的。
1. 19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是
A.提出了原子学说 B.发现了元素周期律
C.提出了分子学说 D.制定了科学完整的元素周期表
2. 从某微粒的原子结构示意图反映出
A.质子数和中子数
B.中子数和电子数
C.核电荷数和核外电子层排布的电子数 D.质量数和核外电子层排布的电子数
3.
![]() 下列微粒中:①12Mg2+ ②
③
下列微粒中:①12Mg2+ ②
③![]() ④O2—,核外电子总数相同的是
④O2—,核外电子总数相同的是
A.②③④ B.①②④ C.①②③ D.①③④
4. 下列叙述中,正确的是
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
5. 下列有关原子结构的说法,正确的是
A.稀有气体元素原子的最外层电子数都是8 B.非金属元素的最外层电子数都大于3
C.金属元素的最外层电子数不都小于4 D.所有原子核都是由质子和中子构成的
6. 若aAn+与 bB2-两种离子的核外电子层结构相同,则a等于
A.b+n-2 B.b+n+2 C.b-n-2 D.b-n+2
7. 在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.一定是金属元素
B.可能是稀有气体元素
C.一定不是非金属元素 D.原子容易失去电子的元素
8. 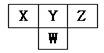 下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
A.原子半径的大小顺序是W>Y>Z
B.X的氢化物没有Z的氢化物稳定
C.常见的X的氢化物具有正四面体结构
D.Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键
9. 构成下列四种物质的微粒间,既存在离子键又存在共价键的是
A.K2S
B.Na2O2
C.MgCl2
D.SO3
10.下列各组物质的性质顺序,不正确的是
A.原子半径:Na<Mg<Al
B.热稳定性:HCl>HBr>HI
C.酸性强弱:H2SiO4<H2CO3<H2SO4
D.熔点:SiO2>NaCl>CO2
11. 下列各化学式中,所有原子(或离子)都满足最外层为8电子结构的化合物是
下列各化学式中,所有原子(或离子)都满足最外层为8电子结构的化合物是
A.D2O
B.NH3 C.Cl2 D.NaCl
12.C60分子结构 与足球 形状相似,它与金刚石 互为
A.同位素 B.同分异构体 C.同素异形体 D.同种物质
13.关于物质结构的下列各种叙述,正确的是
A.含有共价键的晶体,一定是原子晶体
B.离子晶体中,一定存在金属元素和非金属元素;
C.同时含有离子键和共价键的化合物,既可能是离子化合物,也可能是共价化合物
D.在共价化合物中一定存在共价键,但含有共价键的不一定是共价化合物
14.砹(At)是原子序数最大的ⅦA元素,试根据同族元素性质的相似性和递变性分析,下列各个推论,其中错误的是
A.HAt很稳定
B.AgAt既不溶于水也不溶于硝酸
C.砹单质易溶于有机溶剂 D.砹单质在常温、常压下是固体
15.
![]()
![]()
 下列各组物质,属于同分异构体的是
下列各组物质,属于同分异构体的是
A. 与
B. 和
C.![]() H2和
H2和![]() H2
D.H2O与H2O2
H2
D.H2O与H2O2
16.下列化学式中,只表示一种纯净物的是
A.C B.CH4 C.C2H6O D.C4H10
17.![]()
![]()
![]() 下列各项中表达正确的是
下列各项中表达正确的是
A.NH3分子的电子式:
B.CH4分子的比例模型:
C.O原子的结构示意图:
D.N2的结构式: N≡N
18.含有共价键的分子晶体是
A.NaOH B.SiO2 C.Cl2 D.NH4Cl
19.要使下列物质(①金刚石、②食盐、③干冰、④水晶、⑤金属铝)熔化,需要克服微粒间的相互作用,其中克服的相互作用属于同种类型的是
A.①④ B.②③ C.③④ D.①⑤
20.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是
A.电解水
B.干冰受热直接变成气体
C.HCl溶解于水
D.打雷放电时,O2变成O3
第Ⅱ卷 (非选择题 共40分)
21.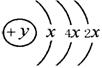 (6分)A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3 和BC2 ,A的原子结构示意图右图,据此填空:
(6分)A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3 和BC2 ,A的原子结构示意图右图,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为 。
(3)B和D最高价氧化物的水化物化学式分别为 和 。
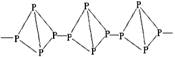
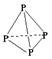
22.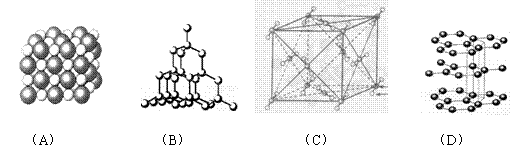 (10分)如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(10分)如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同) ,金刚石属于 晶体。
(2)其中代表石墨的是 ,其晶体中碳原子呈平面 结构排列。
(3)其中代表NaCl的是 ,晶体中Na+与Cl-之间通过 键结合起来。
(4)代表干冰的是 ,它属于 晶体,CO2分子间通过 结合起来。
(5)上述物质中前三种熔点由高到低的排列顺序为 。
23.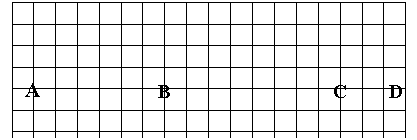 (8分)下图是元素周期表的框架图,请根据下面提问回答:
(8分)下图是元素周期表的框架图,请根据下面提问回答:
(1)在上面元素周期表中全部是金属元素的区域为
① A ② B ③ C ④ D
(2)在短周期元素中,请用化学式填写,与水反应最剧烈的金属元素是 ;元素的气态氢化物最稳定的物质是 ;元素的最高价氧化物所对应的碱其碱性最强的物质是 ;元素的最高价氧化物的水化物中酸性最强的是 。
(3)用物质的名称填写,硬度最大的是单质是 。
(4)短周期中,原子半径最大的非金属元素的原子是 (填写化学式)。
24.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是 (填写编号);与H2最容易化合的非金属单质是 (写物质名称)。
(2)写出元素③形成的氢化物的电子式_____________________________;
(3)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 。
(4)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式___________________________________;________________________________。
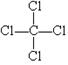
25.(6分)某金属重2.4 g,其原子核外有1.2 mol 电子,核内共有7.224×1023个中子,该金属与足量盐酸反应,有0.2 mol电子发生转移,生成了6.02×1022个阳离子。
(1)该金属元素符号是____________,摩尔质量是____________。
(2)原子核内有________个质子,________个中子。
(3)写出该金属与盐酸反应生成的氯化物的电子式 。
26.(附加题,10分)已知:A、B、D、E为四种短周期元素,它们的核电荷数A<B<D<E;A与B可生成共价化合物AB2,每个AB2分子中含有22个电子;D元素与A元素为同主族元素,E元素原子的最外层电子数比次外层少1个。试回答下列下列问题:
(1)写出AB2的电子式 ;
(2)写出A与E形成的共价化合物的结构式_____________ ;
(3)写出E-的结构示意图 ;
(4)D元素和B元素也能形成DB2型共价化合物,但它与AB2相比,在物理性质却有着巨大反差。请你从结构上给予合理的解释 。
高一化学“微观结构与物质的多样性”试题
参考答案
第Ⅰ卷 (选择题 共60分)
1.B 2.C 3.B 4.B 5.C 6.B 7.B 8.C 9.B 10.A
11.D 12.C 13.D 14.A 15.A 16.B 17.D 18.C 19.A 20.B
第Ⅱ卷(非选择题 共40分)
21.(6分)硅 、SiH4 ; O S P Si;H2SO4 H3PO4
22.(每空1分,共10分)
(1);B;原子 (2)D;层状 (3)A;离子键
(4)C;分子;范得华力(或分子间作用力);(5)(B)>(A)>(C)
23.(8分)
(1) ② ; (2)Na、HF、NaOH、HClO4;
(3)金刚石; (4)Si
24.(10分)(1)② 氟气 (2)H:![]() : 或H :
: 或H :![]() :
:![]() : H
: H
(3)PCl3或CCl4 ;第三周期、ⅥA族
(4)Al(OH)3+3H+ Al3++3H2O和Al(OH)3+OH—=AlO2—+2H2O
25.(6分)(1)Mg;
24g/mol; (2) 12;
12 (3)[:![]() :]-
Mg2+[:
:]-
Mg2+[:![]() :]-
:]-
 | |||||
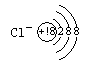 | |||||
26.( 10分)(1) (2) (3)
(4)因为SiO2是原子晶体,原子间通过很强的共价键结合起来。而CO2是分子晶体,分子间通过较弱的范得华力结合起来。
