高一化学必修模块一结业测试卷
考生须知:
1.考生解题时请仔细分清普通中学和重点中学该做的题目;
2.全卷分卷Ⅰ和卷Ⅱ,四大题,共29小题,满分100分;考试时间90分钟;
3.本卷所有答案必须做在答题卷的相应位置上,做在试卷上无效;
4.请用圆珠笔或钢笔答题,并在答题卷相应位置写上班级、姓名和座号;
5.本卷可能用到的相对原子质量:H:1 O:16 N:14 Cu:64
第Ⅰ卷(选择题 共54分)
一、选择题:(每小题只有一个正确答案。普通中学做1~18题,重点中学做4~21题。每小题3分,共54分。)
1.(普通中学做)下列物质不属于“城市空气质量日报”报道的是 ( )
A.二氧化碳 B.氮氧化物 C.二氧化硫 D. 悬浮颗粒
2.(普通中学做)根据元素的核电荷数,不能确定的是 ( )
A.原子核内质子数 B.原子核外电子数
C.原子最外层电子数 D.原子核内中子数
3.(普通中学做)患甲状腺肿大是边远山区常见的地方病,下列元素对该病有治疗作用的是( )
A.钠元素 B.氯元素 C.碘元素 D.铁元素
4.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物属于下列分散系中的 ( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
5.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律的摆
放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放
回的位置是 ( )
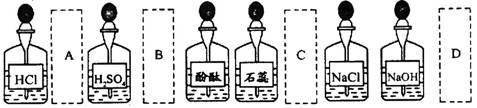 |
6.只含有一种元素的物质 ( )
A.可能是纯净物也可能是混合物 B.可能是单质也可能是化合物
C.一定是纯净物 D.一定是一种单质
7.新买的铝锅、铝壶用来烧开水时,凡是水浸到的地方都会变成黑色,这是由为水中含有的某种可溶盐与铝作用引起的,你认为该可溶盐是 ( )
A.钠盐 B.钾盐 C.钙盐 D.铁盐
8.据报载我国最近合成了多种元素的新的同位素,其中一种是![]() Hf(铪),它的中子数是( )
Hf(铪),它的中子数是( )
A.72 B.113 C.185 D.257
9.判断下列叙述哪项正确 ( )
A.标准状况下,1mol任何物质的体积约为22.4L
B.1mol气体的体积约为22.4L
C.1mol氖气和1mol氧气体积相同
D.标准状况下,lmol氖气和氯气的混合气体(任意体积比)的体积约为22.4L
10.氯气可以用来消灭田鼠,使用方法是将氯气通过软管灌入田鼠洞中,这是利用了氯气以下性
质中的 ( )
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤能溶解于水
A.①②③ B.②③ C.③④ D.③④⑤
11.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是 ( )
A.稀H2SO4 B.氢氧化钠溶液 C.氯化铵溶液 D.硫酸铁溶液
12.光纤通信是70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使
用,光纤通信的光导纤维是由下列哪种物质经特殊工艺制成 ( )
A.碳 B.石英 C.锗 D.硅
13.“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是 ( )
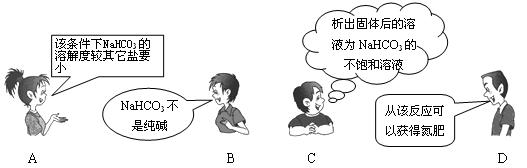 |
14.在NO2与水的反应中,NO2的作用 ( )
A.既是氧化剂又是还原剂 B.是氧化剂
C.是还原剂 D.既不是氧化剂又不是还原剂
15.工业上制造镁粉是将镁蒸气在某气体中冷却。可作为冷却气体的是 ( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.②③ C.③④ D.③⑤
16.下列仪器常用于物质分离的是 ( )
 |
① ② ③ ④ ⑤ ⑥
A.①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
17.美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难——石棉污染,使吸入石棉纤维者易患肺癌。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为:Ca2MgXSiYO22(OH)2,
X、Y的值分别为 ( )
A.5,8 B.8,3 C.3,8 D.5,5
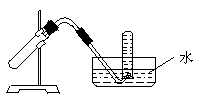 18.右图装置可用于 ( )
18.右图装置可用于 ( )
A.加热NaHCO3制CO2
B.Cu和稀HNO3反应制NO
C.NH4Cl与浓Ca(OH)2溶液反应制NH3
D.Cu和浓HNO3反应制NO2
19.(重点中学做)高温下硫酸亚铁发生如下反应:2FeSO4![]() Fe2O3+SO3↑+SO2↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
( )
Fe2O3+SO3↑+SO2↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
( )
A.BaSO3和BaSO4 B.BaS C.BaSO4 D.BaSO3
20.(重点中学做)现有NaCl、MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl六种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是 ( )
A.浓NaOH B.AgNO3 C.浓氨水 D.H2SO4
21.(重点中学做)用铝热法还原下列化合物,制得金属各1mol,需消耗铝最少的是 ( )
A.Cr2O3 B.WO3 C.MnO2 D.Co3O4
第Ⅱ卷(非选择题 共46分)
二、填空题:(普通中学做22~24题,重点中学做23~25题,本题共24分)
22.(普通中学做)(9分)下列三组物质中,均有一种物质的类别与其它三种不同:
A.MgO、Na2O、CO2、CuO
B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):A ;B ;C 。
(2)这三种物质相互作用可生成一种新物质,该反应 氧化还原反应(填“是”或“不是”), 所生成新物质的化学式为______________。
23.(7分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法
之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使
CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的
转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式: 。
(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其主要原因是 。
A. CO转化为CO2,产生了碳酸酸雾
B. SO2转化为SO3,产生了硫酸酸雾
C. NO转化为NO2,产生了硝酸酸雾
(3)“绿色化学”的最大特点在于它是从源头上实现污染预防的科学手段。为控制汽车尾气污染,下列措施符合绿色化学思想的有 (多选扣分)。
A. 开发氢能源 B. 使用电动汽车
C. 植树造林 D. 戴上呼吸面具
24.(8分)某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
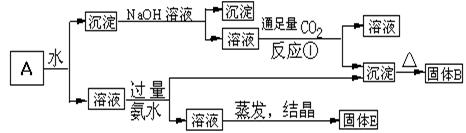 |
据此判断:
(1)固体B所含物质的化学式为 ;
(2)固体E所含物质的化学式为 ,俗称 ;
(3)写出反应①的离子方程式(或化学方程式) 。
25.(重点中学做)(9分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、
Al3+、 Fe3+、SO42-、CO32-、Cl-、I-中的一种或几种,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的离子有______________。
三、实验题:(本题共16分)
26.(6分)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无此药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
若糖衣有损坏,如何检验药片是否已变质?写出主要实验步骤及实验现象 。
27.(10分)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
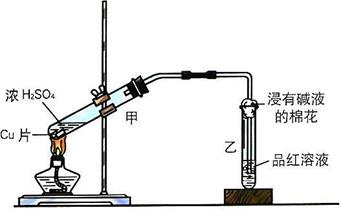 |
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成 。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成 。
写出甲装置中发生的主要反应的化学方程式 。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液或氢氧化钠溶液,写出棉花中发生的任一化学反应的离子方程式 。
(3)在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请你任写一种: 。
四、计算题:(普通中学做第28题,重点中学做第29题。本题6分)
28.(普通中学做)在一定的条件下,将6.4g与铜粉投入足量的浓硝酸中,充分反应后铜粉无剩余。求:
(1)能生成多少克硝酸铜?
(2)能制得标准状况下二氧化氮多少升?
29.(重点中学做)在一定的条件下,将1.92g铜粉溶于50mL物质的量浓度为2mol/L的稀硝酸中,充分反应后铜粉无剩余。求:
(1)能制得标准状况下一氧化氮多少升?
(2)被还原的硝酸的物质的量是多少?
(3)若反应后溶液的体积不变,则溶液中NO3-物质的量浓度是多少?
参考答案
一、选择题:(普通中学做1~18题,重点中学做4~21题。每小题3分,共54分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | A | D | C | D | C | A | D | B | D | B | D |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| 答案 | B | C | A | C | B | A | B | C | A | D |
二、填空题:(普通中学做22~24题,重点中学做23~25题,本题共24分)
22.(9分)(1)A:CO2(2分); B:H2O(2分); C:Na2CO3(2分)。
(2) 不是 (1分) NaHCO3(2分)
![]() 23.(7分)(1) 2CO+2NO
23.(7分)(1) 2CO+2NO![]() 2CO2+N2 (3分) (2) B(2分) (3) A、B (2分)
2CO2+N2 (3分) (2) B(2分) (3) A、B (2分)
24.(8分)(1)Al2O3 (2分) (2)(NH4)2SO4(2分), 硫铵(或肥田粉);(2分)
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- [或:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3](2分)
25.(9分)I-、NH4+、Ba2+;(3分)SO42-、CO32-、Mg2+、Al3+、Fe3+;(3分)
K+、Na +、Cl-(3分)
三、实验题:(本题共16分)
26.(6分)保护FeSO4不被空气中的氧气氧化成Fe2(SO4);( 2分)
取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显血红色,则表明该药片已变质。( 4分)
|
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O。(2分)
(2)CO32-+SO2=SO32-+CO2↑ 或2OH-+SO2=SO32-+H2O(2分)
(3)装置甲试管内溶液变黑色浑浊;反应开始时铜片表面变黑;铜片表面有气泡产生;反应结束后试管底部有白色(或黑色)固体生成;(任写一种,其它合理答案均给分)(2分)
四、计算题:(普通中学做第28题,重点中学做第29题。本题6分)
28.(1)18.8g (2)4.48L (各3分)
29.(1)0.448L (2)0.02mol (3)1.6mol/L (各2分)