第二章 第三节 氧化还原反应
一、选择题(只有1个正确答案;共6小题,每小题3分,共18分。)
1.有关氧化还原反应实质的说法中正确的是 ( )
A.是否有元素的电子转移 B.是否有元素的化合价的变化
C.是否有氧元素的参加 D.是否有原子的重新组合
2.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是 ( )
A.化合反应一定是氧化还原反应 B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应 D.复分解反应不一定是氧化还原反应
3.下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是 ( )
A.实验室中用稀硫酸与锌粒反应制取 H2 B.实验室中用浓盐酸与二氧化锰加热制Cl2(见P3-20)
C.实验室中用高锰酸钾加热分解制取 O2 D.实验室中用稀盐酸与石灰石反应制取CO2
4.下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3![]() Na2CO3+CO2↑+H2O D.CaO+H2O===Ca(OH)2
Na2CO3+CO2↑+H2O D.CaO+H2O===Ca(OH)2
5.氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是
A.金属冶炼 B.燃放鞭炮 C. 食物腐败 D.点制豆腐
6. 从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是 ( )
A.Na2S B. S C. SO2 D. H2SO4
二、选择题(有1-2个答案,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。共10小题,每小题4分,计40分。)
7.下列说法中,能够判断一个反应是否是氧化还原反应的是 ( )
A.反应前后,元素是否有电子转移 B.反应前后,元素是否有化合价变化
C.反应前后,是否有氧元素参加 D.反应前后,是否有氢元素参加
8.对溶液中的离子反应存在下列几种说法,其中正确的是 ( )
A.不可能是氧化还原反应 B.只能是复分解反应
C.可能是置换反应 D.可能是化合反应
9.下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是 ( )
A.Na+、Ba2+、Cl-、SO42- B. Ca2+、HCO3-、C1-、K+
C.MnO4-、K+、I-、H+ D. H+ 、Cl- 、Na+ 、CO32-
10.属于氧化还原反应的离子方程式的是 ( )
A.CaCO3+2H+ = Ca2++CO2↑+H2O B.2Fe2++Cl2 = 2Fe3++2Cl-
C.HCO3-+H+ = CO2+H2O D.2Na+2H2O = 2Na++2OH-+H2↑
11.下列化学变化中,需加入氧化剂才能实现的是 ( )
A.C→CO2 B.CO2→ CO C.CuO→Cu D.H2SO4→BaSO4
12.氧化还原反应发生在同种元素之间的是 ( )
A.Zn+2HCl=ZnCl2+H2↑ B.2H2S+SO2=3S+2H2O
C. H2+CuO=Cu +H2O D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
13.下列反应中氯元素被氧化的是 ( )
A.5Cl2+I2+6H2O=10HCl+2HIO3 B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl=MnCl2+2H2O+Cl2↑ D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
14.下列反应中,电子转移发生在同种元素之间的是 ( )
A.2H2S+SO2=3S+2H2O
|
C.2KClO3 2KCl+3O2↑ D.Cu2O+H2SO4=CuSO4+Cu+H2O
15.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
16.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
三、填空题(计42分)
17.(11分)在氧化还原反应中,氧化剂______电子,发生的反应是_________反应;还原剂________电子,发生的反应是__________反应。铁与氯气反应的方程式为________________________________,生成物中铁是_______价,铁与盐酸的反应式为____________________________,生成物中铁是_____价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)_______。
18.(8分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
19.(10分).阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有 性,铁离子具有 性,(1)中的维生素C是 剂,(2)中的CO2 剂,写出(2)中的离子方程式 。
20.(13分)实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题: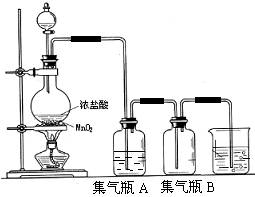
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
知识盘点 1 氧化还原反应的有关概念及概念间的关系
1.理解氧化还原反应有关概念的内涵
| 狭义涵义 | 广义涵义 | 本质涵义 | |
| 氧化反应 | 得到氧的反应 | 元素化合价升高的反应 | 失去电子的反应 |
| 还原反应 | 失去氧的反应 | 元素化合价降低的反应 | 得到电子的反应 |
| 氧化还原反应 | 发生了氧的得 失的反应 | 有元素化合价 升降的化学反应 | 有电子转移(得失 或偏移)的反应 |
氧化剂:反应中元素化合价降低的物质(或得电子的物质)。
还原剂:反应中元素化合价升高的物质(或失去电子的物质)。
氧化产物:失电子被氧化后的生成物。
还原产物:得到电子被还原后的生成物。
2.把握有关概念之间的关系
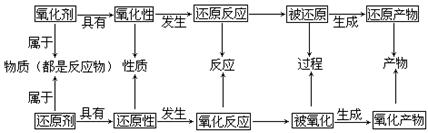
口诀:升(化合价升高)失(失电子)氧(被氧化,发生氧化反应)还(做还原剂,本身具有还原性),降(化合价降低)得(得电子)还(被还原,发生还原反应)氧(做氧化剂,本身具有氧化性)。
理顺关系、拓宽思路
1.氧化剂具有氧化性,发生还原反应,被还原成还原产物。
2.还原剂具有还原性,发生氧化反应,被氧化成氧化产物。
3.凡是有电子转移(包括电子得失或电子对转移),则必出现元素化合价的改变,有关联系为:
化合价升高![]() 失去电子
失去电子![]() 是还原剂
是还原剂![]() 被氧化
被氧化
化合价降低![]() 得到电子
得到电子![]() 是氧化剂
是氧化剂![]() 被还原
被还原
4.有的反应中氧化剂与还原剂是同一种物质,如: Cl2+2NaOH![]() NaCl+NaClO十H2O中的Cl2
NaCl+NaClO十H2O中的Cl2
有的反应中氧化产物与还原产物是同一种物质,如: Cu+Cl2![]() CuCl2中的CuCl2
CuCl2中的CuCl2
第二章 第三节 氧化还原反应
参 考 答 案
一、选择题1.A 2.C 3.D 4.B 5.D 6.A
二、选择题7. AB 8.C 9.C 10.BD 11.A 12.B 13.CD 14.AD 15.B 16.A
三、填空题
17.(每空1分,化学方程式2分)得到
;还原; 失去; 氧化; 2Fe+3Cl2![]() 2FeCl3;+3;Fe+2HCl====FeCl2+H2↑;+2;强
2FeCl3;+3;Fe+2HCl====FeCl2+H2↑;+2;强
18.(前两空各2分,后四空各1分)氮和硫;碳;KNO3和硫;碳 ;CO2 ;K2S和2NO2 。
19.(每空2分,)还原性;氧化性;还原;氧化;CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+
20 .(每空1分,离子方程式2分,计算结果各3分)(1)是;MnO2;浓盐酸;4H++2Cl-+MnO2![]() Cl2↑+Mn2++2H2O;
Cl2↑+Mn2++2H2O;
(2)除去氯气中混有的HCl气体 (3)浓氢氧化钠(浓碱)
知识盘点 2 氧化还原反应的广泛应用
氧化还原反应在工农业生产、科学技术和日常生活中有着广泛的应用,现作一些简单介绍。
我们所需要的各种各样的金属,都是通过氧化还原反应从矿石中提炼而得到的。例如,制造活泼的有色金属要用电解或置换的方法;制造黑色金属和其他有色金属都是在高温条件下用还原的方法;制备贵重金属常用湿法还原等等。许多重要化工产品的制造,如合成氨、合成盐酸、接触法制硫酸、氨氧化法制硝酸、食盐水电解制烧碱等,主要反应也都是氧化还原反应。石油化工里的催化去氢、催化加氢、链烃氧化制羧酸、环氧树脂的合成等也都是氧化还原反应。
在农业生产中,植物的光合作用、呼吸作用是复杂的氧化还原反应。施入土壤的肥料的变化,如铵态氮转化为硝态氮,SO转变为H2S等,虽然需要有细菌起作用,但就其实质来说,也是氧化还原反应。土壤里铁或锰的化合价态的变化直接影响着作物的营养,晒田和灌田主要就是为了控制土壤里的氧化还原反应的进行。
我们通常使用的干电池、蓄电池以及在空间技术上应用的高能电池都发生着氧化还原反应,否则就不可能把化学能变成电能,或把电能变成化学能。
人和动物的呼吸,把葡萄糖氧化为二氧化碳和水。通过呼吸把贮藏在食物分子内的能量,转变为存在于三磷酸腺苷(ATP)高能磷酸键的化学能,这种化学能再供给人和动物进行机械运动、维持体温、合成代谢、细胞的主动运输等。煤炭、石油、天然气等燃料的燃烧更是供给人们生活和生产所必需的大量的能量。
由此可见,在许多领域里都涉及到氧化还原反应,学习和逐步掌握氧化还原反应对同学们的生活和今后参加工作都是很有意义的。