高一化学上学期重点中学期末联考
高一化学试题
命题:武汉十一中 滕维生
审题:武汉三中 胡承国
武汉六中 尹丹丹
第I卷(共60分)
可能需要的相对原子质量:Al—27,Na—23,Cl—35.5,C—12,O—16,Li—6.9,Na—23,K—39,Rb—85.5,Cs—132.9
一.选择题(本题中各小题均只有一个选项符合题意,请将其序号选出填在第II卷卷首的答案栏中,每题3分共60分)
1.下列保存物质的方法正确的是( )
A.液氯贮存在干燥的钢瓶里
B.少量的锂、钠、钾均保存在煤油中
C.浓溴水保存在带橡皮塞的棕色细口瓶中
D.用排水法收集满一瓶氢气,用玻璃片盖住瓶口,瓶口朝上放置
2.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir〕元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是![]() 。 则其核内的中子数是
。 则其核内的中子数是
A.77 B.114 C.191 D.268
3.下列实验操作所用仪器合理的是( )
A.将CCl4与溴水混合后振荡、静置,再用分液漏斗分离得到溴的四氯化碳溶液
B.用100mL容量瓶配制50mL0.1mol/LNaOH溶液
C.用托盘天平称取25.30gNaCl
D.用50mL量筒量取4.8mL硫酸
4.能证明次氯酸是弱酸的是( )
①HClO见光分解 ②HClO能使有色布条褪色 ③0.01mol/L的HClO溶液中H+浓度远小于0.01mol/L ④NaClO溶液吸收空气中的CO2生成HClO
A.①② B.②④ C.①④ D.③④
5. 下列物质的水溶液,能和小苏打反应,且既无气体产生又无沉淀生成的是( )
A.苏打 B.氯化氢 C.烧碱 D.熟石灰
6.M2O7X-与S2-在酸性溶液中发生如下反应:M2O7X-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7X-中M的化合价是( )
A.+2 B.+3 C.+4 D.+6
7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I —=2Fe2++I2
8.下列反应的离子方程式正确的是( )
A.碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+= Ca2++2CO2↑+2H2O
B.将氯气通入到氯化亚铁溶液中:2Fe2++Cl2 = 2Fe3++2Cl-
C.金属钠跟水反应:Na+2H2O = Na++2OH-+H2↑
D.稀硫酸跟氢氧化钡溶液反应:H++SO42-+Ba2++OH- = BaSO4↓+H2O
9 .设阿伏加德常数为NA。则下列说法正确的是( )
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+ 数为0.2NA
10.氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是( )
A.HI和HClO B.HCl和HIO
C.HClO3和HIO D.HClO和HIO
11.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X所在的主族序数是其周期序数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由强到弱的顺序为Z>Y>X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
12.有一未知浓度的稀硫酸25mL,先加入25mL5mol/LBaCl2溶液后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液25mL恰好完全中和。则稀硫酸的物质的量浓度为
A.0.5mol/L B.1.0mol/L C.1.5mol/L D.2.0mol/L
13.将高锰酸钾和氯酸钾的混合物加热,待反应完全后,向残余固体中加入浓盐酸并加热,在整个实验过程中不可能产生的气体是( )
A.氧气 B.氯气 C.氯化氢 D.氢气
14.将足量二氧化锰与40mL10mol/LHCl充分反应产生的氯气同0.1mol二氧化锰与足量的浓盐酸充分反应产生的氯气相比( )
A.前者产生的氯气较多 B.一样多
C.后者产生的氯气较多 D.无法比较
15.同温同压下,某容器充满氧气重116g,若充满CO2重122g,现充满某气体X重114g。则该气体的相对分子质量为( )
A.28 B.60 C.32 D.44
16.向含有等物质的量的NaCl和NaBr的混合溶液200 mL中通入足量的氯气,反应完全后将溶液蒸发,得干燥固体5.85g。则原混合溶液中c(Cl-)为( )
A.0.1mol/L B.0.25mol/L C.0.5mol/L D.1.0mol/L
17.甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
18.已知氨水的密度随浓度增大而减小。若以ω1和ω2分别表示浓度为 a mol/L和 b mol/L的氨水的溶质质量分数,且知2a = b。则下列判断正确的是( )
A.2ω1= ω2 B.2ω2= ω1 C.ω2>2ω1 D.ω1<ω2<2ω1
19 .A、B、C、D、E是核电荷依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族。下列推断不正确的是( )
A.A、B、E一定不在同一周期
B.A、D可能在同一主族
C.C的最高氧化物的水化物可能呈碱性
D.C和D的单质可能化合形成离子化合物
20.X、Y、Z是三种相邻的短周期元素,X和Y同周期,Y和Z同主族,三种元素的原子序数之和是31,最外层电子数之和是17。则X、Y、Z三种元素应是下列的
A.N、O、S B.F、O、S C.P、S、O D.Cl、S、O
 高一化学上学期重点中学期末联考
高一化学上学期重点中学期末联考
高一化学答题卡
第I卷答题卡(共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷(共50分)
21.(15分)(1)实验室用二氧化锰跟浓盐酸反应制取氯气的化学方程式为:
。
(2)高锰酸钾固体、氯酸钾固体分别与浓盐酸共热也可用于制备氯气,其反应式为(未配平):
KmnO4+HCl ![]() KCl+MnCl2+Cl2↑+H2O
KCl+MnCl2+Cl2↑+H2O
KClO3+HCl ![]() KCl+Cl2↑+H2O
KCl+Cl2↑+H2O
等物质的量的MnO2、KMnO4、KClO3分别与足量浓盐酸反应,生成的氯气的物质的量之比为 。
(3)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]中的b~c部分,以求达到同样的目的。
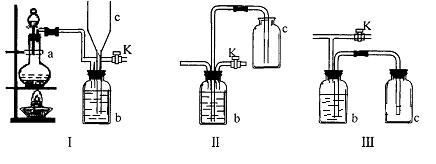
试回答:
①若用[Ⅰ]取氯气,b瓶加入的液体一般为 。在选取试剂正确且适量的前提下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是 检查的简单方法是 。
②装置[Ⅰ]中b能防止多余气体逸散的原因是: 。
③欲用[II]或[III]代替[I]中的b~c部分(选用液体相同),是否可行?(填“是”或“否”)[II]是否可行 ;[III]是否可行 。
22.(8分)(1)实验室保存饱和氯水的方法是 。
(2)用滴管将新制饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,褪色的原因可能有两种(用简要文字说明)①是由于 ;②是由于 。简述怎样用实验证明红色褪去的原因是①或者②: 。
23 .(7分)以下是某些物质间的转化关系图:
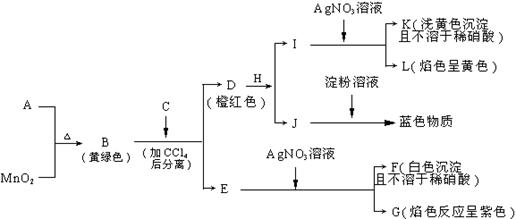
完成下列问题:
(1)物质H的化学式是 。
(2)写出下列转化反应的离子方程式:
B→D: ;
E→F: 。
(3)写出K的一种用途 。
24.(10分)(1) M、N是元素周期表中同一主族相邻的两种元素,M在第三周期,原子序数为a,N在第四周期,则N的原子序数为 。
(2) A、B、C是元素周期表短周期中的主族元素,且原子序数依次增大。A元素的原子最外层电子数是次外层的3倍,B和C的原子序数之和是A的原子序数3倍,B和C形成的简单离子具有相同的电子层结构。试回答下列问题:
①C离子的结构示意图为 ; A、B、C形成的简单离子的半径由大到小的顺序是 。
②A与B形成的原子个数为1:1的化合物与水发生反应的化学方程式为:
。
③A与B形成的化合物与C的最高价氧化物的水化物发生反应的离子方程式为:
。
25.(10分)某碱金属元素的碳酸正盐和碳酸酸式盐组成的混合物样品6.14 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况下)和消耗稀盐酸的体积,得到下图所示的曲线。
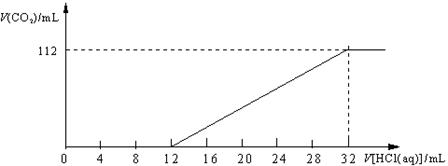
试计算:
(1)混合物中碳元素的质量分数。
(2)确定这两种盐的化学式。
(3)所滴加盐酸的物质的量浓度。