高一化学上期期末试题
注意事项:
1.答题前,必须将自己的班级、姓名填写在第2张试卷密封线内。
2.1~25题选出答案后,填写在第Ⅰ卷答案栏的方格内。
3.本试卷共120分,考试时间为120分钟。
可能用到的相对原子质量:H—1 He—4 C—12 N—14 O—16 S—32 Na—23
第Ⅰ卷(选择题,共50分)
本卷共25题,每题2分,共50分。每小题只有一个选项符合题意。
1.下列是人类活动中应用化学反应所放出能量的事例,其中年代最久远的是
A.用火烤熟食物 B.用炸药爆破
C.将人造卫星送入太空 D.用手电筒照明
2.下列物质中属于纯净物的是
A.氯水 B.液氯 C.漂白粉 D.盐酸
3.某化工厂由于管理不善,水滴到某种化学品上而酿成火灾,该化学品可能是
A.NaOH B.NH4NO3 C.金属钾 D.Na2CO3
4.下列氯化物中,能直接利用金属与稀盐酸反应得到的是
A.FeCl3 B.CuCl2 C.FeCl2 D.AgCl
5.下列物质放置在空气中,因发生氧化还原反应而变质的是
A.Na2O2 B.Na2O C.NaOH D.NaHCO3
6.根据下列物质中N的化合价判断,下列说法中错误的是
A.HNO3具有氧化性 B.N2既有氧化性,又有还原性
C.NH3具有还原性 D.NO只具有还原性
7.下列各组物质中,不能起反应的是
A.Na2CO3溶液与Ca(OH)2溶液 B.Na2SO4溶液与Cu(OH)2
C.Na2O与H2O D.NaHCO3溶液与Ca(OH)2溶液
8.下列各组物质中,括号内为杂质,其中除杂方法不正确的是
A.Na2CO3固体(NaHCO3) 加热 B.I2(砂子) 加热
C.Na2O2(Na2O) 氧气中加热 D.Cl2(HCl) 通过NaOH溶液
9.下列叙述中,正确的是
A.H2SO4的摩尔质量是98 g
B.等质量的O2和O3中所含的氧原子个数相等
C.等质量的CO和CO2中所含的碳原子个数相等
D.将40
g NaOH溶解于500 mL水中,所得溶液中NaOH的物质的量浓度为2 mol•L![]()
10.检验氯化氢中是否混有少量Cl2,可采用的方法是
A.将气体通入AgNO3溶液中
B.将气体通入水中,并观察溶液的颜色
C.将气体通过干燥的有色布条
D.将气体通过湿润的淀粉碘化钾试纸
11.下列化工生产过程中所发生的反应不属于氧化还原反应的是
A.用金属钠制过氧化钠
B.用氯气制漂白粉
C.煅烧石灰石制生石灰
D.电解饱和食盐水制氯气(2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑)
2NaOH+H2↑+Cl2↑)
12.106 g Na2CO3 和84 g NaHCO3分别与同浓度的过量的稀硫酸反应,下列叙述正确的是
A.两者放出的CO2一样多 B.Na2CO3放出的CO2多
C.NaHCO3消耗的硫酸多 D.Na2CO3反应快
13.下列各组离子,能在溶液中大量共存的是
A.K![]() 、H
、H![]() 、Cl
、Cl![]() 、CO
、CO![]() B.CO
B.CO![]() 、Cl
、Cl![]() 、K
、K![]() 、Ca
、Ca![]()
C.Cu![]() 、Na
、Na![]() 、OH
、OH![]() 、NO
、NO![]() D.Mg
D.Mg![]() 、Na
、Na![]() 、SO
、SO![]() 、Cl-
、Cl-
14.氢化钙中氢元素为-1价,它可用作生氢剂,反应的化学方程式是:
CaH2+2H2O![]() Ca(OH)2+2H2↑,对该反应的下列叙述中不正确的是
Ca(OH)2+2H2↑,对该反应的下列叙述中不正确的是
A.水是氧化剂
B.水既不是氧化剂又不是还原剂
C.氢化钙是还原剂
D.反应中1 mol CaH2失去2 mol电子
15.下列变化一定要加还原剂才能实现的是
A.CO![]() →HCO
→HCO![]() B.Cl2→NaCl
B.Cl2→NaCl
C.Fe2O3→Fe D.Zn→ZnCl2
16.鉴别下列各组物质,只能采用焰色反应的是
A.K2CO3和NaCl B.K2SO4和Na2SO4
C.NaCl和CaCl2 D.NaCl和KNO3
17.下列各组中的两物质反应时,反应条件或反应物的用量改变时,对生成物没有影响的是
A.C与O2 B.NaOH溶液与CO2 C.Na与O2 D.Na与Cl2
18.下列离子方程式中正确的是
A.氢氧化钡溶液与稀硫酸:H![]() +OH
+OH![]()
![]() H2O
H2O
B.氯气与水反应:Cl2+H2O![]() 2H
2H![]() +Cl
+Cl![]() + ClO
+ ClO![]()
C.碳酸氢钠溶液与盐酸反应:HCO![]() + H
+ H![]()
![]() H2O+CO2↑
H2O+CO2↑
D.钠投入水中:Na+2H2O![]() Na
Na![]() +2OH
+2OH![]() +H2↑
+H2↑
19.下列关于碱金属化学性质的叙述中,错误的是
A.它们在空气中燃烧都生成过氧化物
B.它们的化学性质都很活泼
C.它们都能与水反应生成碱和氢气
D.它们都是强还原剂
20.设![]() A代表阿伏加德罗常数,下列说法正确的是
A代表阿伏加德罗常数,下列说法正确的是
A.常温常压下,11.2
L氮气所含氮原子数为![]() A
A
B.1 mol 氧气的质量与![]() A个氧分子的质量相等
A个氧分子的质量相等
C.2.3 g金属钠变成钠离子时失去的电子数为![]() A
A
D.0.1 mol·L![]() CaCl2溶液中所含Cl
CaCl2溶液中所含Cl![]() 数为0.2
数为0.2![]() A
A
21.2005年3月29日晚,京沪高速公路准安段一辆载有约35 t液氯的槽罐车与一辆货车相撞,槽罐车坠入河中,导致液氯大面积泄漏。为防止氯气中毒,采取的下列措施不合理的是
A.迅速疏散附近居民,尽可能转移到更高远的地方
B.迅速拦截河水或就地开挖池塘集中泄漏物,并用烧碱、石灰进行处理
C.救援人员及过往群众用蘸有溴化钾溶液或Na2CO3溶液的毛巾捂住口鼻,以防中毒
D.消防官兵向空中喷洒大量的石灰水来消除或减轻污染
22.在0℃和101 kPa的条件下,将2.00 g 氦气、1.40 g氮气和1.60 g 氧气混合,该混合气体的体积是
A.13.44 L B.10.08 L C.7.84 L D.6.72 L
23.为了研究金属钠的性质,将一小块钠投入盛酚酞溶液的烧杯中。这一实验不能证明金属钠的下列哪条性质
A.钠的熔点是97.81℃
B.钠的密度小于水的密度
C.钠能与水发生剧烈反应并有气体生成
D.钠很活泼容易被水氧化成氢氧化钠
24.在适当条件下,30 mL NxHy气体完全分解生成30 mL N2和60 mL H2(同温同压下测定),则NxHy的摩尔质量为
A.16 g·mol-1 B.17 g·mol-1 C.32 g·mol-1 D.34·mol-1
25.在相同体积、相同物质的量浓度的酸中,必然相等的是
A.H![]() 的物质的量
B.溶质的质量分数
的物质的量
B.溶质的质量分数
C.溶质的质量 D.溶质的物质的量
第Ⅱ卷(非选择题,共70分)
26.(4分)在一个小烧杯中,加入20 g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4Cl 晶体,并用玻璃棒搅拌。
(1)实验中观察到的现象有 和反应混合物成糊状,并伴有刺激性气味产生。
(2)通过 现象,说明该反应为 (填“吸”或“放”)热反应,这是由于反应物的总能量 (填“大于”、“小于”或“等于”)生成物总能量。
27.(6分)用NaOH固体配制100 mL
1.0 mol•L![]() NaOH溶液。
NaOH溶液。
(1)需NaOH固体 g。
(2)配制时必须使用的定量玻璃仪器是 ,使用该仪器前必须进行的一步操作是 。
(3)若配制过程中出现下列情况,则会导致“偏低”误差的是(填编号) 。
A.称量NaOH固体时,由于操作不熟悉,时间过长
B.将刚溶解的NaOH溶液立即移入容量瓶中,趁热定容
C.定容时不慎加水超过刻度,再用滴管小心吸出,使溶液的凹液面正好与刻度相切
D.容量瓶刚好洗过,残留有少量蒸馏水
28.(12分)现有K2CO3、NaOH、CuCl2、AgNO3四种溶液,分别置于A、B、C、D四支试管中并进行下述实验:
①将A、B中溶液混合,产生蓝色沉淀。
②将A、D中溶液混合,产生白色沉淀,加入稀硝酸,沉淀不溶解。
③将C、D中溶液混合,产生白色沉淀,加入稀硝酸,沉淀溶解,且有气泡产生。
根据上述实验现象,回答下列问题:
(1)四支试管中的溶液分别是:A ,B ,C ,D 。
(2)写出实验①、②、③中有关反应的离子方程式:
实验① ;
实验② ;
实验③ 。
 29.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。试 计算:
29.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。试 计算:
(1)该盐酸的物质的量浓度为多少?
(2)取该盐酸25 mL与足量石灰石反应,理论上可制得标准状况下的二氧化碳多少升?
|
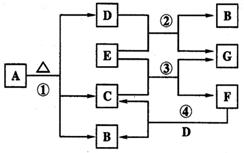
回答下列问题:
(1)写出下列物质的化学式:A ,
E 。
(2)写出下列反应的化学方程式,是离子反
应的写离子方程式。
反应①: ,
A的溶液与F的溶液: 。
(3)经反应③产生的G在标准状况下为1.12 L,则电子转移的物质的量为 mol,反应E的质量为 g。
31.(10分)下面是关于药物华素片(西地碘片)使用说明书中的部分内容。
|
① 华素片中含有的活性成分是
(写分子式)。
② 华素片的贮藏方法
。
(2)某学生为验证华素片中确实含有上
述活性成分,完成实验如下,请填写:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向该试管中再加入约2 mL (填选项字母),并用力振荡;
A.酒精 B.NaOH溶液 C.四氯化碳 D.盐酸
②描述加入该液体后观察到的现象 ;
③选用该液体做实验的原因是 。
(3)请再设计另一种方法,验证华素片中的活性成分(简述实验操作、现象和结论)。
。
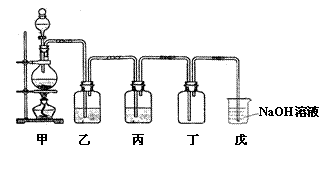 32.(20分)某学生设计的用浓盐酸与二氧化锰反应制取并收集纯净氯气的装置如图:
32.(20分)某学生设计的用浓盐酸与二氧化锰反应制取并收集纯净氯气的装置如图:
(1)写出甲中发生反应的化学方程式,并标出电子转移情况。
。
(2)乙中盛的试剂是 ,作用是 ;丙中盛的试剂是 ,作用是 。
(3)丁中收集到的是纯净的氯气吗?为什么?
。
(4)如果将过量二氧化锰与20 mL 12 mol•L![]() 的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol ,其主要原因有:①
;
的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol ,其主要原因有:①
;
② 。
(5)实验过程中应缓缓加热的原因是 。
(6)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是 ,有关的离子方程式是 。
(7)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去。甲同学认为产生上述现象的原因可能有两种:
假设① ;假设② 。
请你帮他设计实验证明红色褪去的原因是①还是②。
| 实验操作 | 实验现象 | 结 论 |
| 假设①成立 | ||
| 假设②成立 |
评分标准
第Ⅰ卷(选择题共50分)
1.A 2.B 3.C 4.C 5.A 6.D 7.B 8.D 9.B 10.D 11.C 12.A 13.D
14.B 15.C 16.B 17.D 18.C 19.A 20.B 21.C 22.A 23.A 24.C 25.D
第Ⅱ卷(非选择题共70分)
26.(4分,每空1分)(1)水结冰将玻片与小烧杯粘连在一起 (2)结冰 吸 小于
27.(6分)(1)4.0 g (2分) (2)100 mL容量瓶(1分,只答容量瓶不给分) 检查是否漏水(1分) (3)A C(2分,少选给1分,有错不给分)
28.(12分)(1)CuCl2 NaOH K2CO3 AgNO3 (各1分)
(2)Cu![]() +2OH
+2OH![]() ==Cu(OH)2↓ (2分) Ag
==Cu(OH)2↓ (2分) Ag![]() +Cl
+Cl![]() ==AgCl↓(2分)
==AgCl↓(2分)
2Ag![]() +CO
+CO![]() ==Ag2CO3↓ (2分) Ag2CO3+2H
==Ag2CO3↓ (2分) Ag2CO3+2H![]() ==2Ag
==2Ag![]() +H2O+CO2↑ (2分)
+H2O+CO2↑ (2分)
29.(8分)(1)![]() (HCl)=
(HCl)=![]() =11.8 mol·L
=11.8 mol·L![]() (3分)
(3分)
(2)解:可得到CO2的体积为![]()
CaCO3 +2HCl==CaCl2 +H2O +CO2↑
![]()
|
11.8mol/L×0.025L ![]()
则:2 mol:22.4L=(11.8mol/L×0.025L):![]() …………………………(1分)
…………………………(1分)
解得: ![]() =3.3 L………………………………(2分)
=3.3 L………………………………(2分)
30.(10分)(1)NaHCO3 Na2O2 (各1分)
(2)2NaHCO3![]() Na2CO3+H2O+CO2↑ HCO
Na2CO3+H2O+CO2↑ HCO![]() +OH
+OH![]() ==CO
==CO![]() +H2O (各2分)
+H2O (各2分)
(3)0.1 mol 7.8 g (各2分)
31.(10分)(1)① I2(1分) ②避光、密闭、阴凉处 (1分)
(2)① C (2分) ② 溶液分层(1分),下层紫红色(1分) ③ CCl4与水互不相溶(1分),且碘在CCl4中的溶解度比在水中溶解度大(1分)
(3)取一粒华素片研细,先溶于水配成溶液,再滴加淀粉溶液(1分),如溶液变蓝,说明华素片含碘(1分)
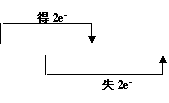
32.(20分)(1)MnO2+4HCl![]() MnCl2+2H2O+Cl2↑(方程式2分,电子转移表示1分)
MnCl2+2H2O+Cl2↑(方程式2分,电子转移表示1分)
(2)饱和食盐水(或水) 除去HCl气体 浓硫酸 除去水蒸气 (各1分)
(3)不是(1分),因排空法收集的气体中含有少量空气(1分)
(4)加热使浓盐酸挥发出大量的HCl(1分) 盐酸变稀后反应不能继续进行(1分)
(5)减少氯化氢的挥发(1分)
(6)NaOH溶液(1分) Cl2+2OH![]() ==Cl
==Cl![]() +ClO
+ClO![]() +H2O(2分)
+H2O(2分)
(7)NaOH溶液被中和而褪色(1分) 氯水中的HClO将酚酞氧化而褪色(1分)
| 向无色溶液中再滴加NaOH溶液(1分) | 若出现红色(1分) |
| 若不出现红色(1分) |