高一化学下学期期中考试
高一化学试卷
满分:100分 考试时间:90分钟 命题老师:汪志华
可能用到的相对原子质量: H:1 C:12 O:16 S:32 Na:23 Cl:35.5 Ba: 137
第Ⅰ卷(选择题共40分)
一、选择题(本题包括20小题;每小题2分,共40分,每小题只有一个选项符合题意)
1.下列粒子的结构示意图正确的是( )


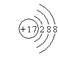
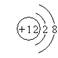
A.Mg2+: B.Cl: C.Ar: D.K:
2.与Ne的核外电子排布相同的阴离子跟与Ar的核外电子排布相同的阳离子所形成的化合物是( )
A.MgBr2 B.Na2S C.CCl4 D.KF
3.某元素R的最高价氧化物的化学式为RO2且R的气态氢化物中氢分数为25%,则此元素是( )
A.C B.N C.Si D. S
4.下列关于氧族元素性质的叙述中,正确的是
A.都能生成+6价化合物 B.都能与金属直接化合
C.原子最外层电子数都是6 D.都能生成稳定的氢化物
5.下列含有非极性键的化合物是( )
A.K2SO4 B.MgCl2 C.N2 D.Na2O2
6.A、B均为原子序数1~20的元素,已知A的原子序数为n,A2+比B2-少8个电子,则B的原子序数是( )
A.n+4 B.n+6 C.n+8 D.n+10
7.元素R的最高价含氧酸的化学式为HnRO2n-2,则在其气态氢化物中R的化合价为( )
A.12-3n B.3n-12 C.3n D.无法确定
8.臭氧(O3)可使湿润的KI淀粉试纸变蓝,反应为2KI+O3+H2O==2KOH+I2+O2,由此反应推断,下列结论正确的是( )
A.O3在反应中被氧化为O2 B.I2为还原产物
C.1 mol O3在反应中得到2 mol电子
D.反应中氧化产物I2与还原产物O2的物质的量之比为1:1
9.SO2和Cl2都具有漂白作用,若将等物质的量的这两种气体,同时作用于潮湿的有色物质。此时可观察到有色物质( )
A.立即褪色 B.慢慢褪色 C.先褪色后复原 D.颜色不褪
10.在体积可变的密闭容器中,将等体积的H2S和SO2在常温常压下混合,发生反应2H2S+SO2==3S↓+2H2O后,气体体积与反应前气体体积之比 ( )
A. B. C.小于 D.大于
11.为了便于计算,有人将98%的H2SO4表示成下列形式,其中合理的是( )
①H2SO4·H2O ②H2SO4·SO3 ③H2SO4·H2O ④SO3·H2O
A.①② B.②③ C.②④ D.③④
12.过氧化氢(H2O2),既有氧化性又有还原性,H2O2和硫酸酸化的KMnO4反应如下:2KMnO4+5H2O2+3H2SO4===2MnSO4+K2SO4+5O2↑+8H2O,如果H2O2中的氧原子是示踪原子(O),当反应完成后,含有示踪原子的物质是( )
A.O2 B.H2O C.MnSO4 D.K2SO4
13.未做实验而欺骗老师的学生是( )
A.老师,我用Na2SO3溶液与BaCl2作用,有白色沉淀生成,加入稀盐酸后沉淀消失
B.老师,我向Ba(OH)2溶液中通入SO2气体,也有沉淀生成
C.老师,我向BaCl2溶液中通入SO2气体,也出现了白色沉淀
D.老师,我向用硝酸酸化过的BaCl2溶液中通入SO2气体,应该没有沉淀产生,可出现了白色沉淀
14.某短周期主族元素R的最高化合价与负化合价代数和为4。则下列叙述中正确的是( )
A.R是第ⅣA族元素 B.R的气态氢化物的化学式RH4
|
|
15.已知下列反应:Cu+X2==CuX2,2Cu+Y==Cu2Y,2KX+Z2=2KZ+X2。X2、Y、Z2为三种元素的单质。在Cu2Y中Y为-2价。下列关于X、Y、Z三种元素的最高价氧化物的水化物的酸性强弱顺序正确的是( )
A.HXO4>H2YO4>HZO4 B.HZO4>HXO4>H2YO4
C.HZO4>H2YO4>HXO4 D.H2YO4>HZO4>HXO4
16.下列叙述正确的是( )
①标准状况下,1molSO2和1molSO3具有相同的体积
②SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有漂白性
③SO2有漂白性,湿润的氯气也有漂白性,若将SO2和Cl2以等物质的量混合后通入品红溶液中,一定褪色更快
④SO2溶于水,得到的溶液有氧化性,还有还原性
⑤SO2通入Ba(OH)2溶液中,有白色沉淀生成,加入稀硝酸最终沉淀将全部溶解
⑥SO2通入BaCl2溶液中无沉淀生成
A.①② B.③⑤ C.④⑥ D.①③⑥
17.下列表示共价化合物的形成过程的电子式正确的是( )
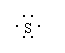
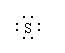 A.Na·+ + ·Na → Na+[ ]2-Na+
A.Na·+ + ·Na → Na+[ ]2-Na+
|
|
|
|
|
 B.2K·+ →
B.2K·+ →
|
|
|
|
|
|
|

 C.H·+ → H+[ ]-
D.2H·+ →
C.H·+ → H+[ ]-
D.2H·+ →
18.某Na2SO3样品已部分氧化为Na2SO4,经测定该混合物中含S 25%,则混合物中Na2SO3与Na2SO4的物质的量之比为( )
A.7 :6 B.6 :7 C.1 :7 D.7 :1
19.最近,科学家制得一种新分子,它具有空心的类似足球状结构,化学式为C60。下列说法中正确的是( )
A.C60是一种新型的共价化合物 B.C60中的化学键均为极性键
C.C60中含有离子键 D.C60的相对分子质量为720
20.下列离子方程式,正确的是( )
A.把稀H2SO4滴在铜片上 Cu+2H+=Cu2++H2↑
B.把醋酸滴在石灰石上 CaCO3+2H+=Ca2++H2O+CO2↑
C.混合碳酸氢钠跟盐酸 CO3 2-+ 2H+ = H2CO3
D.把硝酸银溶液滴入盐酸中 Ag+ + Cl- =AgCl↓
![]()
 高一化学下学期期中考试
高一化学下学期期中考试
高一化学答题卷
第Ⅰ卷(选择题共40分)
一、选择题(本题包括20小题;每小题2分,共40分,每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | A | C | D | A | B | B | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | A | C | C | B | C | D | D | D | D |
第Ⅱ卷 (共60分)
二、非选择题
21.(12分)下表所列为2005年2月在某报纸上公布的我国部分城市空气质量报告,解答下列相关问题
| 城市 | 北京 | 上海 | 天津 | 重庆 | 南京 | 厦门 | 珠海 | 汕头 | 太原 | 长春 |
| 污染指数 | 92 | 74 | 82 | 98 | 95 | 25 | 47 | 54 | 218 | 103 |
| 首要污染物 | TSP | NOX | TSP | SO2 | TSP | TSP | TSP | |||
| 空气级别 | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅰ | Ⅰ | Ⅱ | Ⅳ | Ⅲ |
注:总悬浮颗粒物为TSP;氮氧化物为NOX;二氧化硫为SO2。
(1)上表各城市中,空气质量最好的是 厦门 。(1分)
|
|
答案:①S+O2=====SO2 ②CaO+O2 ====CaSO3 ③2CaSO3+O2===2CaSO4
④2CaO+2SO2+O2===2CaSO4可选①②、②③、①④
(3)减少城市酸雨可采取的途径有 ①④⑤ 。(3分)
①减少用含硫煤作燃料 ②把烟囱建高 ③在已酸化的土壤中加石灰 ④向含硫煤中加入熟石灰、生石灰或石灰石粉末 ⑤开发新能源
![]() (4)汽车尾气(含烃类、CO、SO2与NOX等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转化器”(用铂钯合金作催化剂),使CO与NOX反应,生成可参与大气生态环境循环的无毒气体。写出CO与NOX反应的化学方程式 2xCO+2NOx N2+2xCO2 。(3分)
(4)汽车尾气(含烃类、CO、SO2与NOX等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转化器”(用铂钯合金作催化剂),使CO与NOX反应,生成可参与大气生态环境循环的无毒气体。写出CO与NOX反应的化学方程式 2xCO+2NOx N2+2xCO2 。(3分)
22.(8分)元素a~g原子的最外电子层都是M层,其最外层电子数如下:(8分)
| 元素 | a | b | c | d | e | f | g |
| 最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
用化学符号回答:
(1)原子半径最小的元素是 Cl ;(1分)
|
|
|
|
|
|
|
|
(2分)
(3)元素C的最高价氧化物的水化物又称 两性 氢氧化物(1分):①它与元素g的氢化物的水溶液反应的化学方程式为 Al(OH)3+3HCl===AlCl3+3H2O (3分); ②它与元素a的最高价氧化物的水化物的溶液离子反应可表示为:Al(OH)3+OH-==AlO2-+2H2O 。(3分)
23.(10分)W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中Y为金属元素,W、X、Z为非金属元素。Y和W的最外层电子数相同,Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
 (1)写出元素符号:W为 H ,X为 Na ,Y为
O ,Z为 S 。(4分)
(1)写出元素符号:W为 H ,X为 Na ,Y为
O ,Z为 S 。(4分)
(2)W2Z是由 共价键组成的分子,其电子式为 H S H 。(2分)
(3)由W、X、Y、Z共同组成的化合物的化学式 NaHSO4 。(2分)
(4)W、Y能形成含非极性键的 共价化合物(填“离子”或“共价”),其化学式为 H2O2 。(2分)
24.(13分)下图是有关硫及其化合物的实验装置(如图),其中E装置用来制取H2S气体,实验中用到的试剂可在下列试剂中选择:①70%的硫酸 ②25%的硫酸 ③新开封的Na2SO3粉末 ④硫化亚铁 ⑤NaOH溶液⑥溴水 ⑦Na2CO3溶液。在实验开始后不久即在B瓶中出现黄色粉末状物质。试回答:
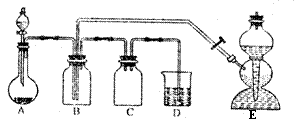 |
(1)A中分液漏斗所盛放的试剂是 ① ⑹,(填序号)烧瓶中盛放的试剂是 ③ ,(填序号)其中实验开始时反应的化学方程式是 H2SO4+NaSO3===Na2SO4+SO2↑+H2O 。
(2)E(启普发生器)中盛有两种试剂发生反应的化学方程式是 FeS+H2SO4===3S↓+2H2O 。
(3)B中反应的化学方程是 2H2S+SO2==3S↓+2H2O ,,反应的氧化产物与还原产物的物质的量之比是 2:1 。
(4) D的作用是 尾气处理 ,C的作用 防倒吸。
(5)如果A、E两装置气体产生的速率相同,流量也相同,在D中发生反应的化学方程是 2NaOH+SO2===Na2SO3+H2O 。
25.(9分)欲测定烟雾中的SO2含量,可做下列实验:取100L该空气(标准状况),通过盛放100mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65g
(1)写出SO2和H2O2反应的离子方程式 SO2+2H2O2==2H++SO4-+2H2O
(2)写出H2SO4与BaCl2反应的离子方程式 Ba2++SO42-===BaSO4↓
(3)100L空气中SO2的体积分数为 1.12%
三、计算题
26.(8分)有一废水样品10 L,经过分析得知游离氯(Cl2)的浓度为0.012 mol·L-1,废水中的H+浓度为0.001 mol·L-1。已知Cl2和Na2SO3在溶液中有如下反应:
Cl2+Na2SO3+H2O===Na2SO4+2HCl
现欲除去其中的游离氯,并成为中性溶液,问:
(1)需加入浓度为0.1 mol·L-1的Na2SO3溶液多少升?
(2)需加入固体烧碱多少克?
答案:(1)1.2L (2)10克