高一化学下学期期中联考试题
高一化学试题(理科)
命题人:长葛三高 李新朵 审核:张春杰
可能用到的相对原子质量:C 12 N 14 O 16 Na 23 Al 27 S 32 Zn 65 Cu 64
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间100分钟。
2.答卷前考生务必将自己的班级、姓名、学号和考试科目用钢笔分别填在第II卷密封线内。
3.第Ⅰ卷答案务必答在第Ⅱ卷的答题栏中,否则不得分;第II卷用钢笔或圆珠笔直接答在试题卷上。
4.考试结束,将第II卷上交(第I卷自己保留好,以备评讲)。
第Ⅰ卷 (选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
1.现有以下几种措施:①对燃烧煤时产生的的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是( )
A.①②④ B.②③④ C.①②③ D.①③④
2.以下有关电子云的描述,正确的是( )
A.电子云示意图的小黑点疏密表示电子在核外空间出现机会的多少
B.电子云示意图中的每一个小黑点表示一个电子
C.电子云是用高速照相机拍摄的照片
D.小黑点表示电子绕核作圆周运动的轨道
3.居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是( )
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是( )
A.一个![]() 原子中含有138个中子
原子中含有138个中子
B.镭的碳酸盐难溶于H2O
C.镭单质与H2O发生剧烈反应,放出H2
D.Ra(OH)2是一种两性氢氧化物
|
A.d单质可跟b的氢化物的水溶液反应
B.原子半径a > b > d
C.c的氢化物比a的氢化物稳定
D.a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性强
5.下列说法中不符合科学的是( )
A.可用食醋除去水壶中的水垢
B.CO气体有毒,在生有炉火的居室中多放几盆水可吸收CO
C.用双氧水(H2O2)清洗伤口可以杀菌消毒
D.臭氧层的破坏对人类健康有害
6. 酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的( )
A.R原子的最外层电子数比N的最外层电子数多1
B.RO3-中R的化合价与NO3-中的N的化合价相等
C.RO3-和NO3-只能被还原,不能被氧化
D.R和N为同族元素
7.下列说法正确的是( )
A.在共价化合物中不可能含有离子键
B.阴阳离子之间通过静电引力形成的化学键,叫离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
8.有aA、bB、cC、dD四种主族元素,已知A、B的阳离子和C、D的阴离子都具有相同的电子层结构,而且原子半径A>B;阴离子所带负电荷数C>D。则四种元素的原子序数关系是( )
A.a >b>c>d B.b>a>d>c
C.c>b>a>d D.b>a>c>d
9.根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体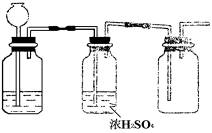 可能是( )
可能是( )
A.Zn和稀H2SO4
B.Na2SO3固体和浓H2SO4
C.FeS和稀HCl
D.MnO2和浓HCl
10.双氧水在医疗上可称为“绿色”外用消毒剂,下列关于H2O2的说法正确的是( )
A.H2O2是共价化合物,具有杀菌消毒作用,是水的同素异形体
B.将H2O2加入酸性高锰酸钾溶液中,溶液的紫色褪去,说明双氧水具有漂白性;
C.H2O2不稳定,易放出O2,此时H2O2主要表现还原性;
D.久置的油画变黑,可用双氧水揩擦后又恢复原貌(PbS +4H2O2=PbSO4+4H2O),因为双氧水具有强氧化性。
11.下列关于臭氧性质的叙述中不正确的是( )
A.臭氧比氧气的氧化性更强,常温下能将Ag、Hg等较不活泼的金属氧化
B.臭氧可以杀死许多细菌,是一种良好的消毒剂
C.臭氧和活性炭一样,能够吸附有机色素,是一种很好的脱色剂
D.臭氧和氧气一定条件下可以相互转化
12.下列五种有色溶液与SO2作用,均能褪色。其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉碘溶液
A.①④ B.①②③ C.②③⑤ D.②③
13.对以下事实解释错误的是( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓H2SO4和铜片加热既表现出酸性,又表现出强氧化性
C.浓硫酸加热时可与木炭反应,还原产物是CO2、SO2
D.反应CuSO4+H2S==CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸
14.用mgCu与足量的浓硫酸共热,当反应完毕后,生成VL的二氧化硫,则被还原的硫酸( )
A.m/64 mol B.V/11.2 mol C.V/22.4 mol D.49V/5.6 mol
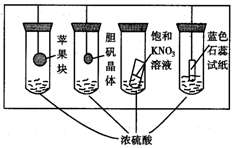 15.在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )
15.在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出
D.蓝色石蕊试纸变红
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)
高一化学下学期期中联考试题
命题人:长葛三高 李新朵 审核:张春杰

| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
选择题答题表:
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
第Ⅱ卷(非选择题 共55分)
二、实验题(包括2小题,共27分)
16.(16分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有产物(均为气体)。已知SO2可使KMnO4溶液褪色,反应化学方程式为:5SO2+2KMnO4+2H2O==K2SO4+2MnSO4+2H2SO4 填写下列空格。 (说明:要求装置中①、②、③三部分装置分别各检验出一种产物)
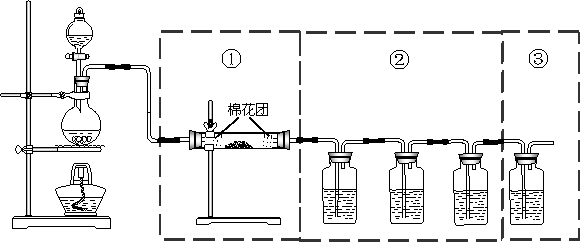
(1)写出木炭与浓硫酸反应的方程式:_________________________________。
(2)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是_____ __,不能检出的物质是____ ____。(用产物的化学式填写,有几个写几个,多写或写错0分)。
(3)实验时可观察到装置②中A瓶的溶液褪色,C瓶的溶液不褪色。
A中所盛放的试剂是__ ____,作用是 ,
B中的实验现象__ ____,作用是 ,
C中所盛放试剂的是___ ___,作用是 。
(4)装置①所加的固体药品是 ,可验证的产物是 。
(5)装置③中所盛溶液是 ,可验证的产物是 ;反应的化学方程式为:_____ ____ ____________________;
17.(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
①请写出铜跟浓硫酸反应的化学方程式:________________________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________________
______________________________________________________________________________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是____________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某学生进行了如下设计:
先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是____________________(填写字母编号,有几个写几个,多写或写错0分)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A中产生气体的体积(气体已折算成标准状况)
(4)如果(3)中测得标准状况下产生SO2的体积为1.792L,则被还原的硫酸的物质的量为 mol。
三、填空题(本题共4小题,共22分)
18. (5分) 归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质/元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | – 218.4 | 113 | 452 | |
| 单质沸点(℃) | – 183 | 444.6 | 685 | 1390 |
| 主要化合价 | – 2 | – 2、+ 4、+ 6 | – 2、+ 4、+ 6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是______________________;
(2)碲的化合价可能有__________________;
(3)硫、硒、碲的氢化物的稳定性由强至弱的顺序是__________________(填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质。
19.(6分) 短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号为:_____________;D的原子结构示意图是:_____________;
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是________________。(用离子符号表示)
(3)CA2与D元素的单质在水溶液中反应的化学方程式是:
_______________________________________________________。
![]()
![]()
 20.(4分)有A、B、C、D、E、F六种短周期主族元素。0.015 mol C元素的单质与足量盐酸完全反应时,有1.806×1022个电子发生转移。E、F两元素间可形成FE2和FE3两种化合物,两者相对分子质量相差16.A、D均能与E原子按1:1和2:1形成两种化合物,其中含A的在通常情况下为液态,含D的在通常情况下为固态。又知A、B、D三种元素原子序数之和是C、E、F三种元素原子序数之和的1/2。请回答下列问题:
20.(4分)有A、B、C、D、E、F六种短周期主族元素。0.015 mol C元素的单质与足量盐酸完全反应时,有1.806×1022个电子发生转移。E、F两元素间可形成FE2和FE3两种化合物,两者相对分子质量相差16.A、D均能与E原子按1:1和2:1形成两种化合物,其中含A的在通常情况下为液态,含D的在通常情况下为固态。又知A、B、D三种元素原子序数之和是C、E、F三种元素原子序数之和的1/2。请回答下列问题:
(1)写出C的元素名称 ;
(2)F位于周期表的第 周期,第 族;
(3)B在E中完全燃烧生成的化合物微粒的电子式是
21.(7分)将下列环境问题所对应的主要原因(A-G)填在相应的空格中(每格中只填一个字母)。
环境问题 产生原因
(1)酸雨_ _ A.空气中CO2浓度不断上升
(2)水土流失_ _ B.大量使用塑料包装袋和塑料农用地膜
(3)臭氧层被破坏_ _ C.工业上大量排放SO2
(4)温室效应_ _ D.大量使用农药和化肥
(5)白色污染_ _ E.生活污水大量排放,使藻类大量繁殖,水体严重缺氧
(6)土壤污染 _ _ F.乱砍滥伐森林
(7)水体“富营养化”_ _ _ G.大量使用氟利昂制品
四、计算题(本题包括1小题,共6分)
22.(6分) 使一定量的锌与100 mL 18.5 mol/L 的浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+) = 0.1 mol/L。请回答下列问题:
(1)反应消耗的硫酸的物质的量为______________;
(2)气体A中含有_______________气体(填化学式),其体积比为___________。
高一化学试题答案(理科)
命题人:长葛三高 李新朵 审核:张春杰
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | A | A | D | D | B | B | A | B | B | D | C | C | C | A | D |
二、实验题(包括2小题,共27分)
16、(16分)(1)
2H2SO4(浓)+C ![]() CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
(2) SO2、CO2 H2O (每空1分共2分)
(3) 品红溶液 检验SO2
足量酸性KMnO4溶液 除去SO2
品红溶液 验证SO2是否除净 (每空1分共6分)
(4)无水硫酸铜固体 H2O (每空1分共2分)
(5)澄清的石灰水 CO2 (每空1分共2分)
Ca(OH)2+CO2=CaCO3↓+H20 (2分)
17.(11分)(1) B装置中导气管长进短出(1分)
(2)①Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O (2分);
CuSO4 + SO2↑+ 2H2O (2分);
②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应(2分);
③A、D(2分)(只写对一个给1分,写出2个给2分,多写或写错0分)
(3)①A、B、C(2分)(只写对一个给1分,写出2个或3个给2分,多写或写错0分)
(4) 0.08(2分)
三、填空题(本题共4小题,共22分)
18. (5分) (1) 113℃<熔点<452℃;(1分)
(2) – 2,+4,+6;(1分)
(3) H2S>H2Se>H2Te(2分)
(4) 还原性(1分)
19. (6分)
(1) O ;Cl的原子结构示意图。 (每空1分共2分)
(2) S2- > O2- > Na+ 。 (2分顺序错0分)
(3) SO2 +Cl2 + 2H2O = 2HCl +H2SO4 (2分)。
20.(4分) (1) 镁 (2) F位于周期表的第三周期,第六主族;
(3) CO2 (每空1分)
21.(7分,各1分)(1) C (2) F (3) G (4) A (5) B (6) D (7) E
四、计算题(本题包括1小题,共6分)
22.(6分) (1) 1.8 mol(2分) (2) SO2、H2(2分) 1∶4(2分)