高一化学下学期期末测试试题
(1)
一、选择题(57分)
1、下列各组物质中,属于同分异构体的是
A、![]() 与
与![]() B、O2和O3
B、O2和O3
C、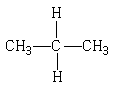 和
和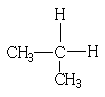
D、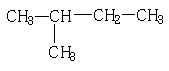 和
和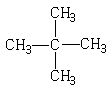
2、甲烷和丙烷混合气体的密度与同温同压下乙烷的密度相同,则混合气体中,甲烷和丙烷的体积之比为
A、1:1 B、1:2
C、2:1 D、2:3
3、某混合物气体有两种气态烃组成,取0.1mol该混合气体完全燃烧后得到4.48L CO2(标准状况)和3.6g H2O,则这两种气体可能是
A、CH4和C3H8 B、CH4和C3H4
C、C2H4和C3H4 D、C2H4和C2H6
4、有机物分子中,所有原子不可能在同一平面上的是
A、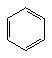 B、
B、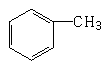
C、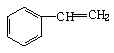 D、
D、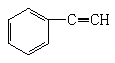
5、下列物质中,在一定条件下既能发生加成反应,又能发生取代反应,但不能使酸性KMnO4溶液退色的是
A、甲烷 B、苯
C、乙烯 D、乙烷
6、某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烃,此氯代烃1mol可与4mol氯气发生完全取代反应,则该烃的结构简式是
A、![]() B、
B、![]()
C、CH3CH3
D、![]()
7、烷烃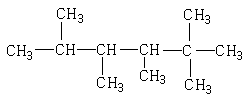 是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有
是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有
A、4种 B、5种
C、6种 D、7种
8、“绿色化学”对于化学反应提出了“原子经济”(原子节约)的新概念及要求。理想的“原子经济性”反应是原料分子中的原子全部转变成所需要的产物,不产生副产物,实现零排放。下列几种生产乙苯的方法的方法中,“原子经济性”最好的是(反应均在一定条件下进行)
A、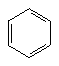 +C2H5Cl→
+C2H5Cl→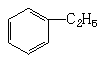 +HCl
+HCl
B、 +C2H5OH→
+C2H5OH→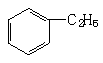 +H2O
+H2O
C、 +CH2=CH2→
+CH2=CH2→
D、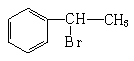 →
→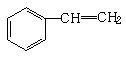 +HBr
+HBr
 +H2
→
+H2
→
9、下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是
A、金属钠 B、溴水
C、碳酸钠溶液 D、无色的酚酞试液
10、可用于检验乙醇中是否含有水的试剂是
A、无水硫酸铜 B、生石灰
C、金属钠 D、胆矾
11、把氢氧化钠溶液和硫酸铜溶液加入某病人的尿液中,微热,如果观察到砖红色沉淀,说明该尿液中含有
A、醋酸 B、酒精
C、食盐 D、葡萄糖
12、实验室用乙酸、乙醇、浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合时,有气泡产生,原因是
A、产品中有被蒸馏的出的H2SO4
B、有部分未反应的乙醇被蒸馏出来
C、有部分未反应的乙酸被蒸馏出来
D、有部分乙酸乙酯分解了
13、用于制造隐形飞机的物质,其主要成分为
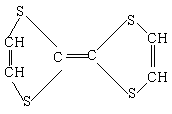 它属于
它属于
A、无机物 B、高分子化合物
C、烃 D、有机物
14、下列反应既属于氧化还原反应,又是吸收能量的化学反应的是
A、铝片与稀盐酸的反应
B、Ba(OH)2.8H2O与NH4Cl的反应
C、灼热的炭与CO2反应
D、甲烷在氧气中的燃烧反应
15、已知H—H键能为436Kj.mol-1,H—N键能为391Kj.mol-1,根据化学方程式:
![]() ,1molN2反应放出的热量为92.4kj。则
,1molN2反应放出的热量为92.4kj。则![]() 键的键能是
键的键能是
A、431kj.mol-1 B、945kj.mol-1
C、649kj.mol-1 D、869kj.mol-1
16、氨分解反应![]() 在容积为2L的密闭容器内进行,已知起始时氨气的物质的量为4mol,5s末为2.4mol,则用氨气表示该反应的速率为
在容积为2L的密闭容器内进行,已知起始时氨气的物质的量为4mol,5s末为2.4mol,则用氨气表示该反应的速率为
A、0.32mol/(L.s) B、0.16mol/(L.s)
C、1.6mol/(L.s) D、0.8mol/(L.s)
17、哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
![]() 现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是
现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是
A、达到化学平衡时,N2将完全转化为NH3
B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D、达到化学平衡时,正、逆反应速率为0.
18、100m L6mol.L-1的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A、碳酸钠固体 B、稀硫酸溶液
C、硫酸钾溶液 D、硫酸铵固体
19、根据下列事实:①A+B2+==A2++B;②D+2H2O==D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e—===E,B-2e—==B2+。由此可知A2+、B2+、D2+、E2+的氧化性强弱的关系是
A、D2+〉A2+〉B2+〉E2+
B、A2+〉B2+〉D2+〉E2+
C、D2+〉E2+〉A2+〉B2+
D、E2+〉B2+〉A2+〉D2+
高密市实验中学下学期期末测试
高一化学试题 (II卷)
二、填空题
20(21分)在实验室中用MnO2和浓盐酸反应制备纯净干燥的氯气。
(1)写出相关所有反应的化学方程式。
(2)下图是一个学生设计的实验装置图
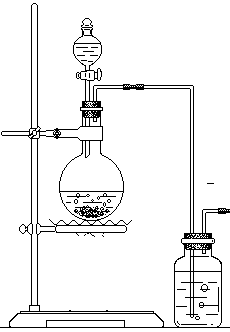
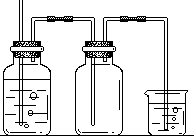
浓硫酸 水 氯气 氢氧化钠溶液
这个装置有哪些错误?请分别指出:
①
②
③
④
⑤
三、计算题:
21.(8分)一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓通过无水CaCl2时,CaCl2增重25.2g,求原混合气体中CO2的质量为多少克?
22.(14分)标准状况下,1.68L无色可燃性气体在足量的氧气中完全燃烧。若将产物通入足量的石灰水中,得到白色沉淀的质量为15.0g;若用足量的碱石灰吸收燃烧后的产物,增重9.3g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式。(只要求写一组)。
试题(1)答案
一、1---5:D、A、B、B、B
6—10:A、B、C、C、A
11—15:D、C、D、C、B
16—19:B、C、C、D
二、20、(1)![]() 、Cl2+2NaOH==NaCl+NaClO+H2O
、Cl2+2NaOH==NaCl+NaClO+H2O
(2)①反应未加热
②浓硫酸和水的位置颠倒
③将水改为饱和食盐水
21、17.8g
22、(1)2.7g (2)C2H4