高一化学下学期期末测试试题(2)
一、选择题(每题只有一个正确答案,每题3分,共51分)
1、某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳物质的量之比为1:1,由此可得出的结论是
A、该有机物分子中C、H、O原子个数比为1:2:3
B、分子中碳氢原子个数比为1:2
C、有机物分子中必定含有氧元素
D、有机物中肯定不含有氧元素
2、将0.2mol某烷烃完全燃烧后,生成的气体缓慢通过盛有0.5L2mol/L-1的NaOH溶液中,生成Na2CO3和NaHCO3的物质的量之比为1:3。则该烷烃为
A、甲烷 B、乙烷
C、丙烷 D、丁烷
3、由乙烯推测丙烯的结构或性质,正确的是
A、分子中三个碳原子在同一直线上
B、分子中所有原子在同一平面上
C、与HCl加成只生成一种产物
D、能发生加聚反应
4、苯环结构中,不存在碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液退色;②苯中碳碳键的键长均相等;③苯能在加热和催化剂存在的条件下氢化生成环己烷;④经实验测得邻二甲苯仅有一种结构;⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因为化学变化而使溴水退色。
A、②③④⑤ B、①③④⑤
C、①②④⑤ D、①②③④
5、两种气态的烃的混合物共0.1mol,完全燃烧后得3.36L CO2(标准状况)和3.6g H2O,下列说法正确的是
A、一定有乙烯 B、一定有甲烷
C、一定有乙烯 D、可能是甲烷和乙烷的混合物
6、将烷烃、烯烃按体积比为5:1混合,混合气体是相同状况下等质量H2体积的1/16,则混和气体的组成为
A、甲烷、乙烯 B、乙烷、丙烯
C、丁烷、丁烯 D、甲烷、丁烯
7、两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃不符合条件的是
A、CH4、C2H4 B、CH4、C3H6
C、C2H4、C3H4 D、C2H2、C3H6
8、若乙酸分子中的O都是18O,乙醇分子中都是16O,二者在一定条件下反应生成物中水的相对分子质量为
A、16 B、18
C、20 D、22
9、下列关于油脂的叙述不正确的是
A、油脂属于酯类 B、油脂没有固定的熔、沸点
C、油脂是高级脂肪酸的甘油脂D、油脂都不能使溴的四氯化碳溶液退色
10、乙烯与乙醇的混合气体VL,完全燃烧生成CO2和H2O,消耗相同状态下的O23VL,则混合气体中乙烯和乙醇的体积比为
A、1:1 B、2:1
C、1:2 D、任意比
11、乙醇在一定条件下发生催化氧化反应时化学键断裂位置如下图
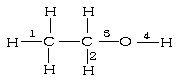
A、2、3 B、2、4
C、1、3 D、3、4
12、下列高分子化合物属于天然高分子材料的是
A、合成橡胶 B、塑料
C、尼龙 D、羊毛
13、下列各组化合物中化学键类型不同的是
A、NaCl和HNO3 B、H2O和NH3
C、CaF2和CsCl D、CCl4和H2O
14、已知可逆反应2A(g)+3B(g)==4C(g),在一定条件下使一定量的A和B气体反应,达到
平衡状态的是
A、各物质的浓度比c(A):c(B):c(C)==2:3:4
B、混合气体中各物质的浓度相等
C、混合气体的体积是反应前的4/5
D、单位时间内若消耗了amol A物质,同时消耗了2amol C物质
15、把下列四种X溶液分别加入四只盛有10m L 2mol.L-1盐酸的烧杯中,然后均加水稀释到
50mL ,其中反应速率最快的是
A、10℃20m L 3mol.L-1的X溶液
B、20℃30m L 2mol.L-1的X溶液
C、20℃10m L 4mol.L-1的X溶液
D、10℃10m L 2mol.L-1的X溶液
16、8.7g MnO2与20m L 10mol.L-1浓盐酸共热,生成Cl2的质量为
A、7.1g B、3.55g
C、小于3.55g D、大于3.55g
17、X、Y是元素周期表第ⅦA族中的两种元素,下列叙述中能说明X的得电子能力比Y强的是
A、X原子的电子层数比Y原子的电子层数多
B、X的氢化物的沸点比Y的氢化物的沸点低
C、X的气态氢化物能比Y的气态氢化物稳定
D、Y的单质能将X从NaX的溶液中置换出来
高一化学试题(2)II
二、填空题(共2大题,38分)
18.(18分)有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的最外层电子数是4,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的半径小,D离子与B离子的电子层结构相同。
A ,B ,C ,D 。
(2)D元素在周期表中位于第 周期 族。
(3)A和B的单质充分反应生成化合物的化学式是 。
(4)四种元素中, 的最高价氧化物的水化物既能溶于酸,又能溶于碱;溶于NaOH溶液的化学方程式为 。
19.(20分)实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在55~60℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后在用蒸馏水洗涤。
⑤将用无水CaCl2干燥的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作注意事项是 。
(2)步骤③中,为了使反应在55~60℃下进行,常用的方法是 。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是 。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是 。
(5)纯硝基苯是无色、密度比水 (填“小”或“大”)的油状液体,它具有
气味。
三、计算题
20.(11分)常温下,A、B两种气态烃组成的混合气体2L(已知B为烯烃),在足量氧气中燃烧,生成4LCO2和4.8LH2O(g)(气体的体积均在同温同压下测定),试推测A、B的分子式及混合气体中各组分的体积分数。
试题(2)答案
一、1—5:B、D、D、C、B
6—10:B、AC、C、D、D
11—15:B、D、A、D、B
16—17:C、C
二、18、(1)C、O、Mg、Al (2)三、ⅢA (3)![]()
(4)D、Al(OH)3+NaOH==Na[Al(OH)4]
19、(1)将浓硫酸慢慢倒入到浓硝酸中,并不断搅拌
(2)水浴加热
(3)分液漏斗、烧杯、玻璃棒
(4)洗去未反应的酸
(5)大、苦杏仁
三、20、n C2H6:n C2H4==2:3