高一化学下学期期末考试试题
本试卷分第Ⅰ卷(选择题)和第II卷(非选择题)两部分。共100分。
考试时间90分钟。
可能用到的原子量:H 1 C 12 O16 N 14 Na 23 Mg 24 S 32
第Ⅰ卷(选择题 共45分)
一、 选择题(本题共9小题,每小题2分,共18分。每小题只有1个选项符合题意)
1.X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是 ( )
A.Mg Al Si B.Li Be Mg C.N O S D.P S O
2.下列关于卤族元素由上到下性质递变的叙述,正确的是 ( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①③⑤
3.对于放热反应A+B![]() C+D,以下说法正确的是(EA、EB、EC、ED分别表示A、B、C、D所具有的能量)
( )
C+D,以下说法正确的是(EA、EB、EC、ED分别表示A、B、C、D所具有的能量)
( )
A.EA>EC B.EA >EC +ED C.EA +EB >EC +ED D.EA+EB <EC +ED
4.对于反应A+3B=2C+D来说,下列反应速率中最快的是 ( )
A. v(A)=0.3mol·L-1·min-1 B.v(B)=0.6mol·L-1·min-1
C. v(C)=0.5mol·L-1·min-1 D.v(D)=0.001mol·L-1·min-1
5.一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是 ( )
2AB(g)达到平衡的标志是 ( )
A.单位时间内生成n mol A2的同时生成n mol的AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol的AB同时生成n mol的B2
D.单位时间内生成n mol A2的同时生成n mol的B2
6.100 ml浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
7.1 mol甲烷和氯气在光照条件下反应生成物质的量相同的4中取代物,则消耗氯气的物质的量是 ( )
A.5mol B.2.5mol C.1mol D.2mol
8.苯加溴水后,溴水层颜色变浅,这是由于 ( )
A.溴挥发了 B.发生了取代反应 C.发生了萃取 D.发生了加成反应
9.下列说法不正确的是 ( )
A.通过煤的干馏可以获得焦炭
B.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来
C.通过煤的干馏可以获得粗氨水
D.煤液化后可以得到甲醇
二、 选择题(本题共9小题,每小题3分,共27分。每小题有1~2个选项符合题意)
10.下列事实不能说明X元素比Y元素的非金属性强的是 ( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
11.据报道,美国科学家制得一种新原子![]() ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是 ( )
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是 ( )
A. 这种原子的中子数为167 B. 它位于元素周期表中的第六周期
C. 这种元素一定是金属元素 D. 这种元素的原子易于氢化合
12.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是
H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
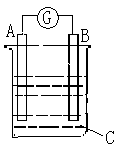 13.如右图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为
( )
13.如右图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为
( )
A. A是Zn,B是Cu,C是稀H2SO4
B. A是Cu,B是Zn,C是稀H2SO4
C. A是Fe,B是Ag,C是稀AgNO3溶液
D. A是Ag,B是Fe,C是稀AgNO3溶液
14.把1L乙烯和氢气的混合气体通过Ni催化剂,使C2H4和H2发生加成反应,反应完全后,气体的体积为yL(均在相同条件下测得)。若乙烯在原混合气中的体积分数为x%,则x和y的关系一定不正确的是 ( )
A.y=x% B.y=1-x% C.y=x%=0.5 D.y=1-x%<0.5
15.乙烯和乙醇的混合气体VL,完全燃烧后生成CO2和H2O,消耗相同状态下的氧气3VL,则混合气体中乙烯和乙醇的体积比 ( )
A.1:1 B.2:1 C.1:2 D.任意比
16.若乙酸分子中的氧都是16O,乙醇分子中的氧都是18O,二者在浓硫酸的作用下发生反应,一段时间后,分子中含有18O的物质有 ( )。
A. 1种 B.2种 C.3种 D.4种
17.向淀粉中加入少量稀硫酸,并加热使之发生水解。为测定水解的程度,需下列试剂中的① NaOH溶液 ② 银氨溶液 ③ 新制Cu(OH)2悬浊液 ④ 碘水 ⑤ BaCl2溶液 ( )
A. ① ⑤ B.② ④ C.① ③ ④ D.② ③ ④
18.工业上获得大量的乙烯、丙烯和甲烷采用的方法是 ( )
A.石油分馏 B.高温干馏 C.石油裂化 D.石油裂解
第Ⅱ卷(非选择题 共55分)
三、填空题(本题包括2小题,共14分)
19.(10分)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。 正极 ,负极 ,电解质溶液 ,电极反应式 、 。
20.(4分)用足量的CO还原14g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中。生成沉淀25g,则这种混合物可能是 (①FeO、Fe2O3;②FeO、Fe3O4;③Fe2O3、Fe3O4);在这些混合物中,各成分的物质的量之比是 。
四、推断题(本题只有1个小题,共16分)
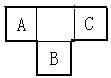 21.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
21.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称 、 、 。
(2)B元素位于元素周期表中第 周期,第 族。
(3)C的原子结构示意图为 ,用电子式表示C的单质与H2反应的过程: 。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有 。
五、实验题(本题包括2小题,共19分)
22.(5分)下图是实验室制备乙酸乙酯的装置图,填写下列空白。
(1)试管A中加入无水乙醇和冰醋酸,但加热后得不到乙酸乙酯的原因 ,
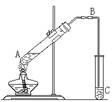 (2)导管B的作用是 ;
(2)导管B的作用是 ;
(3)C中的试剂名称是 ,其作用是
。
(4)要将乙酸乙酯从C中混和物中分离出来,必须
用到的仪器是 。
23.(14分)海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
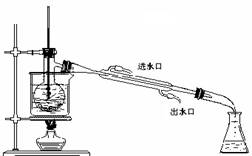


(1)在方框内画出实验操作①的仪器装置示意图(见题后说明)。实验操作③的名称是 ,所用主要仪器名称为 。
(2)提取碘的过程中,可供选择的有机试剂是 (填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量的(填序号) 溶液,反应的离子方程式为 。
A. KIO3 B.KClO C.KI D.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如上图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)
① ,② ,③ ,④ , 。
(5)实验中使用水浴的原因是 ,最后晶体碘聚集在 (填仪器名称)中。
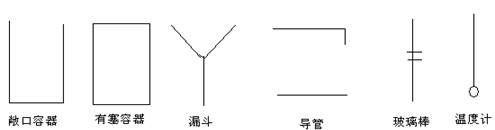
说明:实验装置中的仪器用下面的方法表示。铁架台、连接胶管等不必画出,如需加热,在仪器下方用“![]() ”表示。下列图示均为玻璃仪器,应标清液面或固体可视界面。
”表示。下列图示均为玻璃仪器,应标清液面或固体可视界面。
六、计算题(本题只有1个小题,共6分)
24.室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到至室温,气体体积减少了50 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。求气态烃的分子式并写出该分子式的所有同分异构体。
高一下学期期末考试化学试题参考答案
一、选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | C | C | A | C | B | B | C | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | AC | C | D | D | D | B | C | D |
三、填空题
19.正极:C或Cu ;负极:Zn ;电解质溶液:FeCl3溶液;负极反应式:
Zn-2e-=Zn2+ ;正极反应式:2Fe3++2e-=2Fe3+ (每空2分)
![]() 20.①或③ ;1:2或1:1 (每空2分)
20.①或③ ;1:2或1:1 (每空2分)
四、推断题
21.(1)氮、硫、氟 (2)三 ;ⅥA (3)F
![]()
(4)离子键和极性共价键 (每空2分)
五、实验题
22.(1)未加催化剂浓H2SO4 (2)导气、冷凝 (3)饱和碳酸钠溶液 ;溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度 (4)分液漏斗 (每空1分)
23.(1)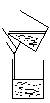 (2分)
萃取分液 ;分液漏斗
(每空1分,共2分)
(2分)
萃取分液 ;分液漏斗
(每空1分,共2分)
(2) B D (2分) (3)C (1分) ICl+I-=Cl-+I2 (2分)
(4) ① 缺石棉网 ② 温度计插到液体中 ③ 冷凝管进出水方向颠倒
(每空1分,共3分)
(5)有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管 ;
蒸馏烧瓶 (每空1分,共2分)
六、计算题
24.解:由题意知:n(烃):n(水):n(二氧化碳)=1:5:4,所以 烃分子中的碳原子与氢原子的物质的量之比为:4:10 所以该烃的分子式为:C4H10 ;