高一化学下学期期末考试题
化 学 试 题
时间:80分钟 总分:100分
可能用到的原子量 H:1 O:16 Na:23 Zn:65 Al:27 C:12 N:14
一、选择题(本题包括5小题,共10分,每小题只有一个正确答案)
1. 现行元素周期表中已列出112种元素,其中元素种类最多的周期是
A、第四周期 B、第五周期 C、第六周期 D、第七周期
2. 下列物质在稀硫酸存在的条件下进行水解,最后生成物只有一种有机物的是
A、蔗糖 B、淀粉 C、 蛋白质 D、 油脂
3. 近年来,科学家在海洋中发现了一种冰状物质――可燃冰,其有效成分是甲烷。下列说法正确的是
①甲烷属于烃类 ②在相同条件下甲烷的密度大于空气 ③甲烷难溶于水
④可燃冰是一种极具潜力的能源
A、①②③ B、②③④ C、①③④ D、①②④
4. 把下列四种X溶液分别加入四个盛有10ml2mol/L盐酸的烧杯中,均加水稀释到50ml,此时,X和盐酸缓慢地进行反应,其中最快的是
A、10℃ 20ml 3mol/L的X溶液
B、20℃ 30ml 2mol/L的X溶液
C、20℃ 10ml 4mol/L的X溶液
D、10℃ 10ml 2mol/L的X溶液
5. 下列互为同位素的是
A.金刚石与石墨 B.12H2和13H2
C.C2H5COOH与CH3COOCH3
D. ![]() Cl与
Cl与![]() Cl
Cl
二、选择题(本题包括15小题,共45分,每小题有一个或两个正确答案)
6. 有A、B两种烃,含碳的质量分数相同,下列关于A、B的叙述正确的是
A、A和B一定是同分异构体
B、A和B不可能是同系物
C、A和B的最简式一定相同
D、A和B各1mol,完全燃烧后生成二氧化碳的质量一定相等
7. 只用一种试剂就可鉴别乙酸溶液,葡萄糖溶液、蔗糖溶液,这种试剂是
A.NaOH溶液 B.Cu(OH)2悬浊液
C.石蕊试液 D.Na2CO3溶液
8. 决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度、压强以及反应物的接触面 D.反应物的浓度
9.
在固定容器中进行的可逆反应H2(g)+I2(g)![]() 2HI(g)达到限度时的标志是
2HI(g)达到限度时的标志是
A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.混合气体的压强保持不变时
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
10. 2005年6月5日是第34个世界环境日,联合国环境署确定今年的活动主题是“营造绿色城市,呵护地球家园”,我国环保总局确定的主题是“人人参与,创建绿色家园”,下列活动不符合这一主题的是
A.推广垃圾分类存放,分类回收,分类处理
B.将工厂的烟囱造高,以减少工厂周围的大气污染
C.推广使用液化石油气(LPG)替代汽油和柴油作公交车和出租车的燃料
D.改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,先开采和综合利用煤层气,然后再采煤。
11. 下列性质中,可证明某化合物内一定存在离子键的是 A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
12. 在绿色化学工艺中,理想状态是反应物中原子全部转化为欲制得的产物,即原子的利用率为100%,在用CH3C≡CH合成CH2=C(CH3)COOCH3过程中,欲使原子利用率达到最高,还需要的反应物有
A.CO2和H2O B.CO和CH3OH C.CH3OH和H2 D.CO2和H2
13. ![]() 葡萄糖发酵过程中可得一种产物叫乳酸,乳酸的结构简式为CH3CHCOOH 。试推断乳酸不具有的性质是
葡萄糖发酵过程中可得一种产物叫乳酸,乳酸的结构简式为CH3CHCOOH 。试推断乳酸不具有的性质是
A、与强碱反应生成盐 B、与醋酸反应生成酯
C、与金属钠反应生成氢气 D、能与银氨溶液反应
14. 将等物质的量的四块铜片在酒精灯上加热后,分别加入到下列溶液中,放置片刻后铜片的质量增加的是
A.硝酸 B.乙醇 C.乙醛 D.石灰水
15. 下列说法错误的是
A.石油含有C5~C11的烷烃,可以通过石油的分馏得到汽油
B.含有C18以上的重油经过催化裂化可以得到汽油
C.沸点:汽油>煤油>柴油>机油
D.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来
16. 已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是
A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq)
B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq)
C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq)
D.1mL18.4mol/LH2SO4和1mL1mol/LNaOH
17. 下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是
A.乙炔(C2H2)和苯(C6H6) B.乙醇和丙醇(CH3CH2CH2OH)
C.乙醇和乙醚(C2H5OC2H5) D.甲醛( HCHO)和乙酸
18.
某元素X的最高价含氧酸的化学式是![]() ,则在其气态氢化物中,X元素的化合价为
,则在其气态氢化物中,X元素的化合价为
A.5n-12 B.3n-12 C.3n-6 D.n-10
19. 下列各组性质比较,完全正确的是
A.酸性:![]() B半径: Al3+>Na+>O2->Mg2+
B半径: Al3+>Na+>O2->Mg2+
C.稳定性:![]() D还原性:I->Br->F->Cl-
D还原性:I->Br->F->Cl-
20.
合成氨反应:![]()
![]()
![]() ,其正逆反应速率可以分别用
,其正逆反应速率可以分别用![]()
表示,当外界条件一定时,下列关系能表示反应达到最大限度的标志是
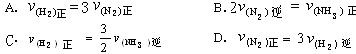
三、填空题(本题共6小题,共36分)
21. (12分)有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素。金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸。E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个。
⑴写出A元素名称:____________,C2粒子的符号:___________。
⑵画出E离子的结构示意图:_______________
⑶写出B与E的单质在常温下化合的化学方程式:_________________。
⑷写出B在周期表中的位置 :__________,D单质的电子式 。
⑸用电子式表示的C和A的形成过程:_______________ 。
(6)写出由C、D和E三种元素形成的离子化合物的化学式是
22. (8分) 如右图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性。E是具有香味的不溶于水的液体。
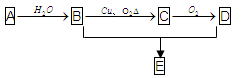 (1)写出B→C的化学反应方程式:
,
(1)写出B→C的化学反应方程式:
,
(2)写出B+D→E的化学反应方程式: ,反应类型为: 。
(3)试写出除去E中混有D的试剂和方法 。
23.
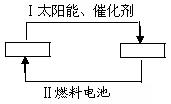 (8分)氢能是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是 能转化为 能。
(8分)氢能是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是 能转化为 能。
24. (6分)由铜、锌和稀硫酸组成的原电池中,负极发生的电极反应是 ,电子的流动方向是 。当导线中有1 mol电子通过时,理论上锌极的变化是 。
25.
(2分)在一个2L的密闭容器中装入4molSO2和2molO2,在一定条件下发生如下反应:2SO2(g)+O2(g)![]() 2SO3
(g) 2分钟达到平衡,此时测得容器中SO2的浓度为0.8mol/L,计算:在2分钟内该反应的SO3平均反应速率
。
2SO3
(g) 2分钟达到平衡,此时测得容器中SO2的浓度为0.8mol/L,计算:在2分钟内该反应的SO3平均反应速率
。
四、计算题(本题共9分)
26. (9分)1.85g某饱和一元醇,完全燃烧后生成的气体通过足量的石灰水产生0.1 mol白色沉淀. 此醇可以被催化氧化成醛. 试推断该醇的分子式和结构简式.
答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | C | B | D | C | B | A | B | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | B | D | CD | CD | B | AD | B | AC | BC |
三、填空题(共36分)
21、 (12分)每小题2分
⑴氟;![]() H2
H2
⑵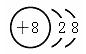 ,
,
![]() ⑶ 4Na+O2═2Na2O
;
⑶ 4Na+O2═2Na2O
;
⑷ 3周期ⅠA族;
⑸![]()
(6)NH4NO3
22、(8分)每空2分
(1)![]()
(2)![]() ,取代反应;
,取代反应;
(3)饱和碳酸钠溶液 分液
23、(8分)每空2分
化学能 电能 (左边)H2O (右)H2和O2
24、(6分)每空2分
Zn - 2e- = Zn2+ ;Zn 到Cu;锌片溶解了32.5 g
25、(2分) 没有单位不得分
0.6mol/(l.min)
四、计算题
26(9分)
设饱和一元醇为CnH2n+2O
据题意:CnH2n+2O——nCO2——nCaCO3
1 n
1.85 0.1
14n+18
分子式C4H10O
结构简式为:CH3CH2CH2CH2OH和(CH3)2CHCH2OH
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | C | B | D | C | B | A | B | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | B | D | CD | CD | B | AD | B | AC | BC |