高一化学上学期期中考试题
化 学
YCYYCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时90分钟。
可能用到的相对原子质量是:H-1 C-12 O-16 Na-23 Cl-35.5 Ca-40
第Ⅰ卷(选择题共49分)
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1.下列物质不属于“城市空气质量日报”报道的是 ( )
A.二氧化硫 B.二氧化氮 C.二氧化碳 D.悬浮颗粒
2.下列叙述中,正确的是 ( )
A.复分解反应一定都属于非氧化还原反应
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
3.下列物质中属于非电解质的是 ( )
A.NaOH B.CO2 C.H2SO4 D. Fe
4.下列变化需要加入还原剂才能实现的是 ( )
A.NH3 → NH4+ B.Fe2+ → Fe C.H2S → SO2 D.Cl-→Cl2
5.下列反应中水只作还原剂的是 ( )
A.2Na +2H2O = 2NaOH + H2↑ B.2Na2O2 + 2H2O = 4NaOH + O2↑
C.2F2 + 2H2O = 4HF + O2 D.Cl2 + H2O = HCl + HClO
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意.只有一个正确选项的,多选不给分.有两个正确选项的,选对一个给1分,选错一个该小题不给分).
6.下列有关Na和Na+性质的叙述中,正确的是 ( )
A.它们的化学性质相似 B.它们都是银白色金属
C.它们都极易被氧化 D.它们灼烧时都能使火焰呈黄色
7.有人预言,H2是21世纪最理想的能源,下列说法正确的是 ( )
A.生产H2的原料来源广阔 B.水的分解反应是一个放热反应
C.H2易液化,携带安全方便 D.使用H2作燃料时有助于环境保护
8.向酚酞试液中加入过量Na2O2粉末,振荡,下列叙述正确的是 ( )
A.溶液最后变成红色 B.溶液最后褪色
C.有气体生成 D.无明显现象
9.对反应2Na2O2+2CO2=2Na2CO3+ O2的正确说法 ( )
A.是置换反应 B.CO2是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.氧化产物和还原产物都是O2
10.根据下列三个反应的化学方程式:I2 + SO2 + 2H2O === H2SO4 + 2HI,2FeCl2 + Cl2 === 2FeCl3,2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 , 有关物质的还原性依次减弱的顺序是:
( )
A.I-、Fe2+、Cl-、SO2 B.Cl-、Fe2+、SO2、I-
C.Fe2+、I-、Cl-、SO2 D.SO2、I-、Fe2+、Cl-
11.下列反应的离子方程式正确的是 ( )
A.澄清的石灰水跟稀硝酸反应: Ca(OH)2+2H+=Ca2++2H2O
B.氢氧化钡溶液和稀硫酸反应: Ba2++ SO42-= BaSO4↓
C.氢氧化钠溶液中加入过量碳酸氢钙溶液: Ca2++HCO3-+OH-=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体: CO2+OH-=HCO3-
12.往某无色透明溶液中加入小块钠完全反应后没有沉淀生成,该溶液中可能大量存在的离子组是 ( )
A.K+、Cu 2+、SO42-、Cl- B.Ba2+、K+、Fe2+、NO3-
C.Na+、NO3-、K+、Cl- D.K+、 Mg2+、Cl-、NO3-
13.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排除气体,残余物质是
( )
A.NaOH和Na2O2 B.NaHCO3和Na2CO3
C.Na2CO3 D.Na2O
三、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意).
14.在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是 ( )
A.Na+、Cu2+、CO32-、Cl- B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+ D.NH4+、 K+、 H+、 SO42-
15.在反应3Cl2+6KOH=KClO3+5KCl+3H2O中,氧化剂与还原剂的质量比为 ( )
A.2︰1 B.5︰1 C.1︰2 D.1︰5
16.离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3Sœ +7H2O,则M2O7X-中M的化合价为 ( )
A.+4 B.+5 C.+6 D.+7
17.已知2FeCl3+Cu=2FeCl2+CuCl2,如果向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是 ( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
18.取10g氢气和CH3OH的混合物在氧气中完全燃烧,将其产物和足量的过氧化钠反应,反应后固体的质量增加了 ( )
A.9g B.10g C.11g D.12g
第Ⅱ卷(非选择题共51分)
四、填空题(本题包括3小题共15分)
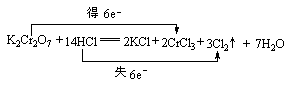
19.(6分)在 K2Cr2O7 + 14HCl![]() ==== 2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
==== 2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的
HCl的质量比为 。
(4)用双线桥标明电子转移的方向和数目。
20.(4分)写出下列反应的离子方程式:
①往NaHSO4溶液中滴加少量Ba(OH)2 溶液
②往装有Na2CO3溶液的试管中逐滴滴入少量HCl溶液
21.(5分)北京时间2005年10月12日9时许, 在酒泉卫星发射中心,长征二号F运载火箭成功将我国自主研制的神舟六号载人飞船送入太空。神州为之而沸腾,世界为之瞩目。
(1)“长征”火箭升空时和大气层剧烈摩擦会产生高温,为了防止火箭表层温度过高,在火箭表面涂有一层物质作为保护层,保护层物质最可能具有的性质是( )
A.硬度很大,熔点很高的物质 B.高温下易分解的物质
C.导热性良好的物质 D.易燃烧的物质
(2)为了使航天员在飞船中得到一个稳定、良好的生存环境,飞船中可以安装一个装有淡黄色颗粒的装置,其用途是再生氧气,写出相关化学方程式 。
五、实验题(本题包括1小题共11分)
22.现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学设计了如下装置进行实验:
 |
(1)A处为加热NaHCO3和Na2CO3·xH2O混合物的装置,画出装置图。
(2)B装置的作用是_________________________________。
(3)若在装置A中装入NaHCO3和Na2CO3·xH2O的混合物7.4克,加热到反应完全,冷却至室温时,测得B管增重3.78克,C管增重0.44克,求出x的值为____________
(4)你认为该装置设计得是否严密_______?(填“是”或“否”);如果不严密,请提出一个合理的改进方案。
六、推断题(本题包括2小题共13分)
23.(7分)处于同一条小河的上、中、下游的甲、乙、丙三座工厂,每厂向小河排放的废液里含有CuCl2、Ca(OH)2、HCl中的一种。环保局对污水监测发现:(1)甲处水域呈乳白色(2)乙处水域变成蓝色浑浊(3)丙处水域由浑浊变清。
问:(1)甲、乙、丙各厂排放的废液 分别是什么?
(2)请写出乙处、丙处水域所起反应的离子方程式。
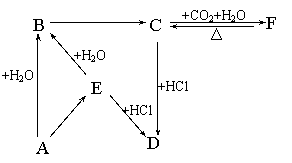 24.(6分)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
24.(6分)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
(1)写出A→B的化学方程式,标出电子转移的方向和数目;
(2)在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是 。
七、计算题(本题包括2小题共 12分)
25.(6分)有一表面被部分氧化的金属钠,质量为10.8g,投入到100g水中完全反应后,收集到0.2g氢气,试计算:
(1) 被氧化的金属钠的质量是多少克?
(2) 未被氧化前金属钠的质量?
(3) 反应后所得溶质的质量分数?
26.(6分)将一定质量的Na2CO3 和NaHCO3混合物加热至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量为100g;将加热后剩余的固体物质与足量盐酸反应,收集到88g气体。计算原固体混合物中Na2CO3 和NaHCO3的质量各为多少?
参考答案
一、选择题
1、C 2、A 3、B 4、B 5、C
解析:
1、二氧化碳非大气污染物
2、Fe既不是电解质也不是非电解质
5、2Na2O2+2H2O=4NaOH+O2↑反应中H2O既不做还原剂也不做氧化剂。
二、选择题
6、D 7、AD 8、BC 9、C 10、D 11、CD 12、C 13、C
解析:
7、H2不易液化,保存运送不方便
8、Na2O2粉末有漂白性
12、Na投入水中生成NaOH
13、NaHCO3受热分解产生H2O和CO2使Na2O2完全反应。最终容器中残余固体只能是Na2CO3。
三、选择题
14、B 15、B 16、C 17、B 18、B
解析:
16、设M2O7x-中M的化合价为n,根据化合价升降守恒
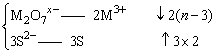
2(n-3)=3×2
n=6。
17、碱金属用M表示,和水反应有
2M+2H2O=2MOH+H2↑
![]() 2
2
0.23 0.01
得合金的平均式量![]() 因为钾的式量大于23。另外一种碱金属式量一定小于23,只能为锂。
因为钾的式量大于23。另外一种碱金属式量一定小于23,只能为锂。
17、若有铁定有 Fe+CuCl2=FeCl2+Cu 即有铁定有铜。
18、![]()
![]()
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
观察得H2和CH3OH消耗的O2与H2O和CO2与Na2O2反应生成的O2的量相等,所以最后固体增加了10g。
四、填空题
19、(1)Cl K2Cr2O7 (2)Cl2 HCl (3)3︰4
20、(1)2H++2OH-+Ba2++SO42-=BaSO4↓+2H2O (2)CO32-+H+=HCO3-
21、(1)B (2)2Na2O2+2CO2=2Na2CO3+O2
解析:(1)保护层物质高温分解时会吸收热量,热量随物质离开而不使火箭表面温度过高。
五、实验题
22、(1)注意点:1、试管口向下略微倾斜 2、导管不能深入试管过长 3、铁夹夹在距试管口三分之一处。 (2)吸收NaHCO3分解产生的水和Na2CO3·xH2O中加热产生的水,用于计算x值。 (3)10 (4)否 C装置末端加干燥管,其中加碱石灰,防止空气中CO2和H2O对x值干扰。
六、推断题
23、(1)甲:Ca(OH)2 ; 乙 :CuCl2 ; 丙 :HCl
(2)Cu2++2OH-=Cu(OH)2↓
Cu(OH)2+2H+=Cu2++2H2O
24、(1) 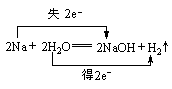
(2)NaOH,CO2通入量不够;NaHCO3,CO2通入过量。
七、计算题
25、答案:(1)4.6g (2)9.2g (3)14.5%
解析:设被氧化的钠xg,未被氧化的钠yg
2Na+2H2O =2NaOH+H2↑
2×23 80 2
x 8g 0.2g
x=4.6g
m Na2O2=10.8g-4.6g=6.2g
4Na + O2=2Na2O
4×23 2×62
Na2O + H2O=2NaOH
62 2×40
6.2g 8g
y=4.6g
4.6g+4.6g=9.2g
![]()
26、答案:m Na2CO3=106g m NaHCO3=168g
解析:
Ca(OH)2 + CO2 = CaCO3↓+H2O
44 100
mCO2=44g 100g
2NaHCO3 = Na2CO3+H2O + CO2↑
2×84 106 44
mNaHCO3=168g m Na2CO3=106g 44g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
m总Na2CO3=212g 88g
mNa2CO3=m总Na2CO3-mNa2CO3
=212g-106g
=106g。