高一化学上学期期中试题
本试卷分为第I卷(第1—3页)和第II卷(第4—5页)两部分。全卷共5页。满分110分,考试时间90分钟。附加题记入总分。
第Ⅰ卷(共52分)
考生注意:
1.答第I卷前,考生务必在客观答题卷Ⅰ上用钢笔或圆珠笔清楚填写姓名、学号,并用铅笔正确涂写学号。
2.第I卷(1—26小题),由机器阅卷,答案必须全部涂写在答题纸上。考生应将代表正确答案的小方格用铅笔涂黑。注意试题题号和答题纸编号一一对应,不能错位。答案需要更改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
3.第II卷第26题和第32题,将答案写在II卷答题卷上。
所需的相对原子质量:C:12/N:14/O:16/H:1/Na:23/P:31/S:32/Ca:40/Cl:35.5/Zn:65/K:39
一、选择题(本题包含25小题,每题2分,共52分。每小题只有一个选项符合题意,多选、错选均不得分。
1、根据物质的分类依据可知,C2H5OH 、NaCl 、CO2 属于同一类物质。下列选项中的物质也可以归类为该类物质的是
A.空气 B. 盐酸 C. 浓硫酸 D. 氧化铜
2、氢氧化钾在我国古代纺织业常用做漂洗的洗涤剂,古人将贝壳(主要成分为碳酸钙)灼烧后的固体(主要成分是氧化钙)与草木灰(主要成分为碳酸钾)在水中相互作用,就生成了氢氧化钾。在上述反应过程中没有涉及的化学反应类型有
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
3、容量瓶上标有以下六项中的A
①温度②浓度③容量④压强⑤刻度线⑥酸式或碱式
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
4、 “纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是
A.有丁达尔效应 B.不能吸附溶液中悬浮物
C.不能透过滤纸 D.所得分散系不稳定
5、苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维 生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
6、1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A . 化学不做实验,就什么都不知道 B . 化学不再需要实验
C. 化学不再是纯实验科学 D . 未来化学的方向是经验化
7、下列叙述正确的是
A. 硫酸的摩尔质量是98 g B.1mol 氧的质量是32g
C.标况下,1 mol任何气体所占的体积都是22.4L D.NA 个O2 物质的量是1mol
8、下列物质属于均匀混合物的是
A.石灰乳 B.氢氧化铁胶体 C.植物油滴入水中 D.空气
9、下列物质的水溶液能导电,但属于非电解质的是
A.HNO3 B.Cl2(Cl2+H2O![]() HCl+HClO)
HCl+HClO)
C.NH4NO3 D.SO2
10、下列说法中不正确的是
①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质
②强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
A.①④ B.①④⑤ C.①②③④ D.①②③④
11、O.25molA的质量是16g,A的相对分子质量(或相对原子质量)是
A 32g·mol-1 B 64×10-3kg·mol-1 C 32 D 64
12、下列化学变化中,需加入氧化剂才能实现的是
A.C→CO2 B.CO2→ CO C.CuO→Cu D.H2SO4→BaSO4
13、1g干冰中含有氧原子a个,则阿伏加德罗常数可表示为
A.22a B.44a C.44a/3 D.14a
14、在盛放酒精的试剂瓶的标签上应印有下列警示标记中的
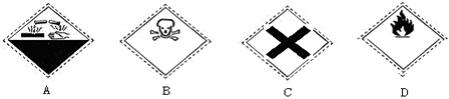
15、同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是
A.A2B B.AB2 C.BA3 D.B3A
16、设NA为阿佛加德罗常数.下列关于0.2mol•L-1 Ba(NO3)2溶液的不正确说法是
A.1L溶液中所含阴、阳离子总数是0.6NA
B.500毫升溶液中含有0.2NA个NO3-离子
C.500毫升溶液中的Ba2+ 物质的量浓度是0.2mol•L-1
D.500毫升溶液中NO3-的物质的量浓度是0.2mol•L-1
17、下列各物质中所含原子个数由大到小的顺序正确的是
①0.5mol氨气;②标准状况下22.4L氦气;③4℃时9mL水;④0.2mol磷酸
A.①④③② B.④③②① C.②③④① D.①④②③
18、下列都能以OH- + H+ = H2O表示的是
A.醋酸和氢氧化钠溶液 B.氢氧化镁和盐酸
C.氢氧化钡和稀硫酸 D.澄清石灰水和硝酸
19、将含有泥砂的粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、FeCl3 、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;⑤过滤
正确的操作顺序是
A.③②①⑤④ B.②③①④⑤ C.①③②⑤④ D.③⑤②①④
20、下列离子方程式正确的是
A、碳酸钙和盐酸反应 CO32- + 2H+ = H2O + CO2↑
B、向氢氧化钡溶液中加硫酸溶液 SO42-+ Ba2+ = BaSO4↓
C、向稀盐酸溶液中加铁 3Fe+6 H+ =3H2↑+3Fe3+
D、向硝酸银溶液中加盐酸 Ag+ + Cl- == AgCl↓
21、一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A.5∶3 B.5∶4 C.1∶1 D.3∶5
22、两份质量相同的CH4和NH3比较,下列结论错误的是
A.分子个数比为17∶16 B.原子个数比为17∶16
C.氢原子个数比为17∶12 D.氢原子质量比为17∶12
23、 若20g密度为d g/cm3硝酸钙溶液中含1gCa2+,则NO3-的物质的量浓度是
A.d/400 mol/L B.20/d mol/L C.2.5d mol/L D.1.25 mol/L
24、下列溶液中的Cl- 物质的量浓度与50毫升1mol•L-1 氯化铝溶液中的Cl- 的物质的量浓度相等的是
A.150毫升1mol•L-1 氯化钠 B.75毫升2mol•L-1 氯化铵
C.150毫升3mol•L-1 氯化钾 D.75毫升1.5mol•L-1 氯化铝
25、将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是C
A.c2=c1 B.c2<c1 C.c2>2c1 D.无法确定
26、(附加题)24mL浓度为0.05mol•L-1的Na2SO3溶液(已知硫元素最高价为+6价),恰好与20mL浓度为0.02mol•L-1的K2Cr2O7 (Cr元素最高价为+6价)溶液完全反应,则元素Cr在被还原的产物中的化合价是
A. +6 B.+3 C.+2 D.0
第Ⅱ卷(共58分)
考生注意:
1.答第II卷前,考生务必将姓名、学号填写湾楚。
2.第II卷从第27题到第32题,考生应用钢笔或圆珠笔将答案填写在答题卷上。
二、填空题(每空2分,共30分本题包含3小题)
27、用化学用语回答下列问题(本题包括4小题,共18分)
(1)(4分)用双线条表示电子转移方向和数目(在题上表明即可)并填空
4NH3+5O2 = 4NO + 6H2O
氧化剂与还原剂的物质的量之比为:——————————————————————
(2)(6分)写出下列反应的离子方程式
①碳酸钠溶液中滴加稀硫酸至过量
②硫酸铜溶液中加氢氧化钡溶液
③实验室用锌和盐酸制取氢气
(3)(4分)根据离子方程式改写成化学方程式:
①CO32- + 2H+ == CO2 ↑+ H2O
②Fe2O3+6H+=2Fe3++3H2O
(4)(4分)写出下列物质在水溶液里的电离方程式
①硫酸钠: ②醋酸:____ ____
28、(8分)甲、乙、丙、丁分别是KCl、NaOH、(NH4)2SO4和Ba(NO3)2四种溶液中的一种,现做如下实验,将甲和乙溶液混合并加热,放出的气体能使红色湿润的石蕊试纸变蓝;若将乙和丁混合出现白色沉淀,该沉淀不溶于盐酸;将丙分和别与甲、乙、丁混合均无异常现象产生。
(1)试确定甲、乙、丙、丁各代表何种溶液。
甲:________,乙:________,丙:_______,丁:_______。
(2)写出甲与乙反应的离子方程式:——————————————————————————
29、(4分)实验室将氯化铁的饱和溶液滴入沸水中来制备氢氧化铁胶体,其化学方程式为———————————,在制得的氢氧化铁胶体中混有少量的Cl- ,欲除去Cl- ,应采用的方法是———————
三、实验题(本题只有1小题,共14分)
30、实验室中有一瓶氯化钾和氯化钙的固体混和物,通过下面的实验可确定该混和物中氯化钾和氯化钙的质量比,也可制得纯净的氯化钾.根据实验步骤填写下列空白.
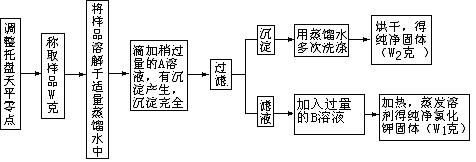
(1)(2分)调整零点时,若指针偏向左边,应将左边的螺丝帽向(填左、右) 旋动.
(2)(2分)某学生用已知质量Yg 的表面皿,准确称取Wg 样品.他在托盘天平的右盘上放入(W+Y)g砝码,在左盘的表面皿中加入样品,这时指针偏向右边(如右图所示),下面他的操作应该是 使 .
 (3)(2分)加入的A是_________________________.
(3)(2分)加入的A是_________________________.
(4)(2分)过滤时,某学生的操作如右下图.请用文字说明图中的错误是:①—————————————②—————————————————
(5)(2分)滤液中加入的B物质是 .应该加入过量的B物质,理由 .
(6)(4分) 配制100mL0.20mol•L-1氯化钾溶液:
 某学生将准确称量的1.5g氯化钾固体放入烧杯中,加入约30nL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯直接倒入100mL容量瓶中,然后沿玻璃棒往容量瓶中小心地加蒸馏水,直到液面接近刻度1—2cm 处,改用胶头滴管加蒸馏水,使溶液凹面最低点恰好与刻度线相切,把容量瓶盖紧,再振荡摇匀.(画横线处不许改动)
某学生将准确称量的1.5g氯化钾固体放入烧杯中,加入约30nL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯直接倒入100mL容量瓶中,然后沿玻璃棒往容量瓶中小心地加蒸馏水,直到液面接近刻度1—2cm 处,改用胶头滴管加蒸馏水,使溶液凹面最低点恰好与刻度线相切,把容量瓶盖紧,再振荡摇匀.(画横线处不许改动)
该生操作中的错误是 和
四、计算题(6分)
31、将标准状况下5.6L氯化氢气体溶于蒸馏水制成100mL溶液,密度为1.1g•mL-1 ,向其中加入足量的锌来制取氢气。回答:
(1) 盐酸的物质的量浓度是多少?
(2) 标准状况下能制得氢气多少升?
(3) 盐酸的质量分数是多少?
附加题(8分,附加题记入总分,总分不超过100分)
32、(8分)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况)。
(1)混合气体中CO的质量是 g;
(2)混合气体中CO2在标准状况下的体积是 L;
(3)合气体的密度是——————————————————————————
(4)混合气体的平均相对分子质量是————————————————————————
答题卷
27、
(1)用双线条表示电子转移方向和数目(在题上表明即可)
4NH3+5O2 = 4NO + 6H2O
氧化剂与还原剂的物质的量之比为:——————————————————————
(2)
①
②
③
(3)
①
②
(4)
① ②____ ____
28、
(1)甲:________, 乙:________, 丙:_______, 丁:_______。
(2)——————————————————————————————————————————————————————————
29、——————————————————————————————————————————————————————————————————-,
———————————————————————————————————————————
30、 (1)(填左、右) 旋动.
(2) 使 .
(3)_________________________.
(4)①————————————————————————————————————————————————————————————
②————————————————————————————————————————————————————————————-
(5) , .
(6) 和
四、计算题(6分)
31、(1)解:
答:盐酸的物质的量浓度是:————————————————————mol•L
(2)解:
答:标准状况下制得氢气的体积是:—————————————————L
(3)解:
答:盐酸的质量分数是: —————————————————
32、(1) g;
(2) L;
(3)——————————————g•L-1
(4)———————————————
1.右 (2分)
2.继续加入样品,指针指在标尺的中间(每空1分,共2分)
3.碳酸钾(或K2CO3)
4.玻璃棒下端没有(或应该)靠在(三层)滤纸上
漏斗颈没有(或应该)靠在烧杯内壁 (每空1分,共2分)
5.盐酸(或HCl) 除尽过量的K2CO3 (每空1分,共2分)
6. 溶液不能直接倒入容量瓶(应沿玻璃棒注入)
没有用蒸馏水洗涤烧杯.玻璃棒
(每空2分,共4分)
28、(6分)实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需玻璃仪器为除玻璃棒、烧杯、量筒和胶头滴管外,还需要:———————————————
(2)本实验须称量碳酸钠晶体(Na2CO3•10H2O),需要在托盘天平右盘加砝码质量总和为 ,游码左边的刻度读数是————————。
26、
29、将正确的答案填在下表的空格中(10分)
| 物质 | N2 | HNO3 | SO2 |
| 质量/ g | 18.9 | ||
| 物质的量/ mol | 2. 5 | ||
| 标况下的体积/ L | 4.48 |
|
32、(6分)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为 、 、 。