高一化学模拟
【主题】 期末1-4章模拟检测
模拟检测2
1、下列物质属于纯净物的是
A.漂白粉 B.盐酸 C.碘酒 D.液氯
2、下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
3、盛液溴的试剂瓶中要加入一定量的水,其目的是
A.制得溴水 B.防止液溴挥发 C.将液溴隔绝空气 D.比较水与液溴的密度
4、下列有关氯水的叙述,正确的是
A 新制氯水可使无色酚酞试纸先变红,后褪色
B 新制的氯水只含Cl2和H2O分子
C 氯水放置数天后,酸性增强
D 光照氯水有气泡逸出,该气体是Cl2
5、在盛有碘水的试管中,加入一定量四氯化碳后振荡,静置片刻后
A.整个溶液变紫色 B.整个溶液变棕色 C.上层无色下层紫红色 D.下层无色上层紫红色
6、在碱性溶液中能大量共存且溶液为无色透明的离子组是
A. K+、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32- C.Na+、H+、NO3-、SO42- D.Fe3+、Na+、Cl- 、SO42-
7、等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是
A.HCO3-+OH-=H2O+CO32-
B.2HCO3-+Ba(OH)2=BaCO3↓+2H2O+CO32-
C.HCO3-+Ba2++OH-=H2O+BaCO3↓
D.2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
8、实验中需用2.0mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为
A.1000mL,212g B.950mL,201.4g
C.100mL,21.2g D.500mL,100.7g
9、将足量的二氧化锰与40mL 10mol/L浓盐酸反应产生的氯气同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比
A.前者产生的氯气多 B.一样多 C.后者产生的氯气多 D.无法比较
10、设NA代表阿佛加德罗常数,下列说法正确的是
A.0.5 mol单质碘作为氧化剂时最多可获得NA个电子
B.10g水分子中所含氢原子的数目为0.5NA个
C.常温常压下为气体的两种物质,当它们的物质的量相同时,在标准状况下必占有相同体积
D.NA个氢气分子与NA个氦气分子的质量比为1︰1
11、造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为
A.2︰3 B.3︰1 C.2︰1 D.1︰2
12、在一定条件下,X2、Y2、Z及M发生下列反应:(1)X2+2M=2MX (2)Y2+M=MY2
(3)X2+Z2-=Z+2X- 在化合物MX和MY2中,X、Y均为-1价,则下列关系正确的是
A、氧化性 X2>Y2>Z B、氧化性 Y2>X2>Z C、还原性 Z2-> Y-> X- D、还原性 Y->X->Z2-
13、用20 mL 0.1mol/L的含氧酸HxRO4溶液与15 mL 0.2mol/L的某碱M(OH)a溶液恰好完全反应,全部生成正盐,则R元素的化合价是
A.+(8-2 a /3) B.+(8-2a) C.+(8-3 a /2) D.+(8-3a)
14、将标准状况下的a L氯化氢气体溶于1000g水中,得到的盐酸的密度为bg/mL,则该盐酸的物质的量的浓度是(单位:mol·L-1)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15、某种混合气体可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化。经干燥后再通过足量的Na2O2固体,气体体积减少。最后通过灼热的铜网,经充分反应后气体体积又减少,但还有剩余气体。以下对混合气体的判断正确的是
A.一定没有N2,HCl和CO至少有一种 B.一定没有N2,HCl和CO都有
C.一定有N2,HCl和CO至少有一种 D.一定有N2和HCl,肯定没有CO
16、VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
17、有FeO、 Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻0.8 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol/L 的盐酸的体积为
A.200mL B.100mL C.50mL D.无法计算
(请注意:将选择题答案填写在下页答题卡上)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | |||||||
18.A、B、C、D、E五种物质转化关系如图所示:
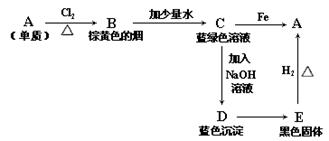
(1)写出化学式:A 、B 、D 、E ;
(2)写出下列各步反应的化学方程式(是离子反应的,只写离子方程式)
A→B ,
C→D ;
19.在2FeS+6H2SO4(浓)=Fe2(SO4)3+3SO2![]() +2S
+2S![]() +6H2O的反应中:
+6H2O的反应中:
(1)氧化剂是____________,还原剂是___________________;
(2)氧化产物是________ _____,还原产物是_________________;
(3)当反应中有0.3mol电子转移则能得到标准状况下的SO2 _____ _____L;
20.“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。请观察下列实验装置,分析实验原理,并回答下列问题:
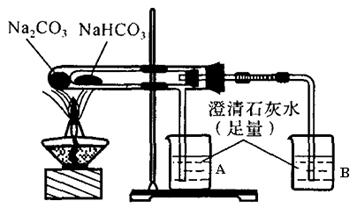
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有
(2)整个实验结束时,在操作上需要特别注意的问题是
(3)通过该实验可以得出的结论是(结合化学方程式来说明)
21.在5.68g CaCO3和MgCO3组成的混合物中加入足量的稀盐酸,产生的全部气体刚好与500mL浓度为0.2mol/L的NaOH溶液完全反应,把所得溶液在较低温度下蒸发至干,得到不含结晶水的固体5.92g。求原混合物中各物质的质量分别是多少克。
18.
(1)Cu、CuCl2、Cu(OH)2、CuO
![]() (2)Cu+Cl2=CuCl2 Cu2++2OH-=Cu(OH)2↓
(2)Cu+Cl2=CuCl2 Cu2++2OH-=Cu(OH)2↓
19.
(1) H2SO4(浓) , FeS (2) Fe2(SO4)3,S (3) 3.36
20.
(1)大试管中无明显变化,小试管内壁上有水珠出现;烧杯A中无明显变化,烧杯B中出现白色浑浊。
(2)先把导气管从烧杯中取出,再移去酒精灯。
![]() (3)NaHCO3的热稳定性不如Na2CO3,2NaHCO3=Na2CO3+CO2↑+H2O。
(3)NaHCO3的热稳定性不如Na2CO3,2NaHCO3=Na2CO3+CO2↑+H2O。
21.
CaCO3:4g;MgCO3:1.68g