高一化学模拟
【主题】 期末1-4章模拟检测
模拟检测4
(选择题答在答题卡上)
1、实验室收集Cl2,最好选用( )
A、向上排空气法 B、向下排空气法 C、排水法 D、排饱和食盐水法
2、见光能分解的盐是( )
A、HClO
B、AgBr C、氯水 D、Ca(ClO)2
3、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( )
A、NaBH4既是氧化剂又是还原剂 B、NaBH4是氧化剂,H2O是还原剂
C、硼元素被氧化,氢元素被还原 D、被氧化的元素与被还原的元素质量比为1:1
4、下列各溶液中,Na+物质的量浓度最大的是( )
A、4L0.5mol/LNaCl溶液 B、1L0.3mol/LNa2SO4溶液 C、5L0.4mol/LNaOH D、2L0.15mol/LNa3PO4
5、下列关于新制氯水及久置氯水的说法,不正确的是( )
A、新制的氯水呈黄绿色,久置的氯水无色
B、新制的氯水漂白作用强,而久置的氯水漂白作用很弱
C、新制的氯水所含成分多,而久置的氯水所含成分少
D、新制的氯水中无氯离子,而久置的氯水中则含氯离子
6、下列各组离子中,能在溶液中大量共存的是( )
A、H+、Ca2+、Cl-、CO32- B、I-、ClO-、K+、H+
C、Na+、Fe3+、SO42-、OH- D、Na+、Cu2+、Cl-、SO42-
7、将同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-完全沉淀,则需同物质的量浓度的AgNO3溶液的体积比为( )
A、1∶2∶3 B、 3∶2∶1 C、1∶1∶1 D、6∶3∶2
8、同温同压下,氦气、氢气和氨气的体积比为3∶2∶1,则其原子个数比为 ( )
A、1∶2∶3 B、4∶3∶3 C、3∶4∶4 D、3∶2∶1
9、把4.48LCO2(标准状况)通过一定量的固体过氧化钠后收集到3.36L气体,则这3.36L气体的质量是( )
A、3.8g B、5.6g C、4.8g D、6.0g
10.消毒液在日常生活中被广泛应用。某消毒液无色,pH>7,对某些有色物质有漂白作用。你认为它可能的有效成分是
A.NaCl B.Na2CO3 C.KMnO4 D.NaClO
11.下列物质之间的化学反应能用离子方程式“H++OH-=H2O”表示的是
A.氢氧化钠和盐酸 B.氢氧化钡和硫酸
C.氨水和硝酸 D.硫酸氢钠和氢氧化钾
12.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中可行的是
A.分别配成溶液,再加入澄清石灰水,观察是否有沉淀生成
B.分别取样后,加入相同物质的量浓度相同体积的稀盐酸,观察反应的快慢
C.分别加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别配成溶液,在火焰上灼烧,观察火焰的颜色
13.设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A.常温常压下,32g O2所含的原子数目为2NA
B.标准状况下,22.4L H2O所含的电子数目为10NA
C.28 g CO和N2的混合气体所含的分子数目为NA
D.23 g Na+ 的物质的量为1mol
14.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2·8H2O 与NH4Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要降温的反应就是放热反应
15.将质量分数为a%的NaOH溶液蒸发掉m g水后,变成V mL 3a%的NaOH溶液(蒸发过程中无晶体析出)则蒸发后所得溶液的物质的量浓度是 (mol/L)
A. B. C. D.
16.下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是
A.碘水 B.溴水 C.氯水 D.氢氧化钠溶液
17.将一定量的金属钠投入下列溶液中,充分反应后,最终不可能有沉淀的是
A.硫酸铜溶液 B.盐酸 C.碳酸氢钙溶液 D.氯化镁溶液
18.设NA代表阿伏加德罗常数的值,下列说法不正确的是
A.阿伏加德罗常数NA是0.012kgl2c中所含的原子数
B.2g氢气所含氢原子数目为NA
C.标况下,22.4LNH3所含的分子数目为NA
D.1 L1mol/L NaCl溶液中所含有的Na+离子数目为NA
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19.实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g
(2)若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_________
(同一步骤可用多次)
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量
D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、加水时越过刻度线_________ B、忘记将洗涤液加入容量瓶__________
C、容量瓶内壁附有水珠而未干燥处理______ D、溶解后没有冷却便进行定容_____
20.下列是几种不同类型的漏斗,用途有差异。
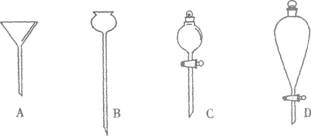
(1)粗盐提纯用到的是_________(填序号,下同);
(2)用CCl4从溴水中提取溴用到的是____________________________
(3)实验室用二氧化锰和浓盐酸加热制氯气用到的是_________________________________
(4)实验室制氢气常用到______________________________________________
21.用18.4mol/L的浓硫酸配制1mol/L稀硫酸lOOmL,其操作有以下各步:
①用量筒量取5.4mL浓硫酸
②洗涤烧杯和玻璃棒2—3次,将洗涤液转入容量瓶中
③将稀释后的硫酸倒人100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释
⑤加水至液面接近刻度线1—2cm处,定容,摇匀
完成下列填空:
(1)正确的操作顺序是(用序号填写)
(2)进行①步操作,应选择________mL量筒(填5、10或50)量取浓硫酸;如果读量筒
刻度时仰视,配制的硫酸浓度将偏_________(填大或小)。
(3)进行④步操作后,必须_________后才能将液体转移到容量瓶中.
22.有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验②③中的离子反应方程式________________________、___________________________,
(3)不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)________________________________________
______________________________________________________________________________
23、实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100ml的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:
(1)理论上需要参加反应的二氧化锰多少克?
(2)浓盐酸的物质的量浓度为多少?
(3)被氧化的HCl的质量为多少克?
19.
(1)14.3
(2)13.7
(3)BADFCFE
(4)500mL容量瓶 托盘天平 玻璃棒 胶头滴管 烧杯
(5)A、偏低 B、偏低 C、不变 D、偏高
20.
(1)A (2)D(或C ) (3)C (4)B
21.
(1)①④③②⑤ (2分) (2)10(1分) 大 (2分)
(3)待溶液冷却至室温(1分)
22.
(1)I-、NH4+、H+ , CO32- 、Mg2+ 、Cu2+
(2)2 I- + Cl2 = I2 + 2Cl- NH4+ + OH- =(加热) NH3↑+H2O
(3)K+、Na+ ;用焰色反应的方法:用一根洁净的铂丝蘸取待测液在无色火焰上灼烧,若观察到黄色火焰则含有Na+ ;再透过蓝色的钴玻璃观察,若看到浅紫色的火焰,则含有K+
23.(1)21.75g (2)10mol/L (3)18.25g