高一化学模拟
【主题】 期末1-4章模拟检测
模拟检测5
提示:选择题答案写在选择题答题卡内
1.下列选项与氯气的用途无关的是
A.消毒灭菌 B.制漂白粉 C.从海水中提取食盐 D.制盐酸
2.下列物质中,属于强电解质的是
A.Fe B. CO2 C. CH3COOH D. H2SO4
3.当不慎有大量Cl2逸出,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,该溶液最适宜采用的是
A.烧碱溶液 B.食盐溶液 C.溴化钾溶液 D.纯碱溶液
4.放置于空气中,易发生氧化还原反应而变质的化合物是
A.Na2O2 B. Na2CO3 C.NaHCO3 D.NaOH
5.翰下列关于金属钠及其化合物的叙述:①苛性钠又称纯碱 ②钠原子最外层电子只有1个电子,所以在化合物中钠只显+1价 ③过氧化钠中氧元素化合价为-1价 ④钠离子具有还原性,可以从水中还原出氢气 ⑤金属钠只有还原性,没有氧化性。上述叙述中正确的是
A. ①②③ B. ③④⑤ C. ②③⑤ D. ①②⑤
6.在1 L溶有0.1mol NaCl和0.1mol MgCl2的溶液中,Cl—的物质的量浓度为
A.0.05mol/L B. 0.1mol/L C. 0.2 mol/L D. 0.3mol/L
7.下列说法不正确的是
A.任何化学反应都伴随有能量变化
B.化学反应中能量变化一定表现为热量变化
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.吸热反应贮备能量
8.关于氧化还原反应,下列说法正确的是
A.氧化剂被氧化,还原剂被还原 B.被氧化的物质是失去电子的物质
C.还原剂发生还原反应 D.失电子、化合价降低的物质是还原剂
9.NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压下,1 mol 水中含有NA个H+和NA个OH-
B.2.24L CO气体所含的分子数为NA
C.0.1mol/L BaCl2溶液中Cl-的数目是0.2NA
D.使56gFe2+还原为单质铁,需得到2NA个电子
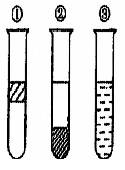 10.如右图在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是
10.如右图在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是
A.①加入的是CCl4,②是苯,③加酒精
B.①加入的是酒精,②加CCl4,③加苯
C.①加入的是苯,②加CCl4,③加酒精
D.①加入的是苯,②加酒精,③加CCl4
11.下列各组中的离子,能够大量共存于同一溶液中的是
A.CO32- 、H+ 、Na+、NO3—
B.H+ 、Ag+、Cl— 、SO42—
C.OH— 、NO3—、 K+、 Na+
D.HCO3—、Na+、OH—、Mg2+
12.配制一定物质的量浓度的NaCl溶液时,造成浓度偏低的原因可能是
A.定容摇匀后,有少量溶液外流
B.定容时,俯视液面
C.称量时,在天平托盘上放上称量纸,将NaCl固体放在纸上称量
D.溶解NaCl的烧杯未洗涤
13.下列各种方法中,可以用于除去苏打中混有的少量小苏打的是
A、水洗 B、加热 C、通入CO2 D、加入盐酸
14.做焰色反应时,下列应注意的操作事项,正确的选项是
①钾的火焰颜色,要透过蓝色钴玻璃观察
② 先把铂丝灼烧到与原来的火焰颜色相同,再蘸取被检物质
③ 每次实验后,要用盐酸把铂丝洗净
④最好选择火焰颜色较浅的煤气灯
⑤也可以用光洁无锈的铁丝代替
A. 仅④不正确 B.仅③ 不正确 C.仅②不正确 D.全部正确
15.下列反应的离子方程式正确的是
A.Cl2通入水中: Cl2+H2O=2H++Cl-+ClO-
B.大理石和盐酸反应:CO32-+2H+=H2O+CO2↑
C.硫酸铜溶液和氢氧化钡溶液:Ba2++SO42—=BaSO4↓
D.铁与稀硫酸反应:Fe+2H+=Fe2++H2↑
16.下列说法中,正确的是
A.除去液溴中少量的氯水,可向其中加少量KI
B.氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果
C.能与硝酸银反应生成白色沉淀的溶液中一定含有Cl—
D.某溶液能使淀粉碘化钾试纸变蓝,则溶液中一定含有Cl2
17.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.45g水中含有的水分子数是2.5NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5L0.2mol/L的NaCl (aq)中含有的Na+数是0.1NA
D.1molCH3+(碳正离子)中原子数目为10NA
18.下列叙述中正确的是 ( )
A.金属阳离子被还原一定得到金属的单质
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.含金属元素的离子不一定都是阳离子
19.下列各组离子在强碱性溶液中大量共存,且溶液呈无色透明的是( )
A、K+、MnO4-、Cl-、SO42- B、Na+、Cl-、NO3-、CO32-
C、Na+、H+、NO3-、Cl- D、Na+、SO42-、HCO3-、Cl-
20.下列实验操作中,正确的是( )
A.为了使过滤速率加快,可用玻棒在过滤器中轻轻搅拌,加速液体流动
B.用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上
C.为加速固体物质的溶解可采用粉碎、振荡、搅拌、加热等方法
D.为增大气体物质的溶解度,常采取搅拌、加热等措施
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21. X、Y两种气体分子的相对分子质量分别为A、B。同温同压下,同质量的X、Y气体,它们的体积比为 ,密度之比为 ;同温同压下的X、Y气体体积相同,则X与Y的质量比为 ,物质的量之比为 。
22.氟、氯、溴、碘的单质中,与氢气混合后在暗处应能发生剧烈反应的是 (写化学式,下同),常温下为深红棕色液体的是 ,不能将其他卤化物中的卤素置换出来的是 。
23.请填写下列空白,以完成卤族元素随着原子半径的增大而发生的递变规律:
(1)卤素的熔沸点逐渐 ;
(2)卤素离子(X-)的还原性逐渐 ;
(3)气态氢化物的稳定性逐渐 ;
(4)卤素单质的氧化性逐渐 。
24.除去下列括号中的杂质,写出所用试剂的化学式与反应的离子方程式:
①SO42-(CO32-) ,所加试剂 ,离子方程式 。
②Cl-( SO42-) ,所加试剂 ,离子方程式 。
③NaHCO3 ( Na2CO3) 所加试剂 ,离子方程式 。
25.实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种试剂一次鉴别它们。甲同学选的是一种正盐溶液,乙同学选的是一种有色试剂,他们都得到了正确结论。试推断甲、乙两位同学选用的试剂:甲 __________ ,乙 _________ 。
26.已知A、B为气体单质,C、D为化合物,它们之间有下列转化关系:
![]() A 点燃 H2O 黑色粉末D并加热
A 点燃 H2O 黑色粉末D并加热
![]()
![]()
![]() C C的水溶液 B
C C的水溶液 B
B
试写出A、B、C、D的化学式:
A B
C D 。
27.某市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。
⑴该浓硫酸中H2SO4的物质的量浓度为 mol/L
⑵欲配制250mL2.0mol/L的稀硫酸溶液,需要取上述浓硫酸 mL
28.有1.56克由Na2O与Na2O2组成的固体混合物样品,为测定各成分的质量分数,按如图所示,原锥形瓶和水总质量为190.72克,将1.56克上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12克,请回答:
⑴写出Na2O2与水反应的化学方程式 。
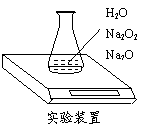 ⑵求样品中各成分的质量分数。
⑵求样品中各成分的质量分数。
21.B:A A:B;A:B 1:1
22.F2 ,Br2 ,I2
23.升高、增强、减弱、减弱
24.(1)H2SO4、CO32-+2H+=H2O+CO2↑ (2) BaCl2、Ba2++SO42--= BaSO4↓
(3)CO2 、CO32- + CO2 + H2O = 2 HCO3-
25.甲:碳酸钠 乙:石蕊试液
26.A.H2 B.Cl2 C.HCl D.MnO2
27.
(1)18.4 mol/L (2)27.2
28.(1)2Na2O2 + 2H2O = 4NaOH + O2↑
(2)氧气质量为:190.72 + 1.56 - 192.12 = 0.16g
2Na2O2 + 2H2O = 4NaOH + O2↑
2×78 32
x 0.16g
x = 0.78g
∴w(Na2O2) = ![]()
w (Na2O) = 100%-50% = 50%