(苏教版)高一化学上学期总复习检测题(一)
班级 学号 姓名
(考试时间:120分钟,满分:150分)
Ⅰ选择题(共70分)
一、(本题共15小题,每小题3分,共45分。每小题只有一个正确选项)
1.用特殊的方法把固体物质加工到纳米级的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是…………………… … ..( )
A.溶液 B.悬浊液 C.胶体 D.乳浊液
2.下列物质是属于非电解质的是……………………………………… ………… ……( )
A.NH3 B.(NH4)2SO4 C.Cl2 D.CH3COOH
3.在下列反应中,水既不是氧化剂又不是还原剂的是…………… ..……… ……( )
A.F2 + H2O (生成O2和HF) B.Na + H2O
C.NaH + H2O(生成H2和NaOH) D.Na2O2 + H2O
4.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为……………………………………………………… ………( )
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
5.等质量的钠进行下列实验,其中生成氢气最多的是..…………………… ………( )
A.将钠投入到足量水中 B.将钠用铝箔包好并刺一些小孔,再放人足量的水中
C.将钠放入足量稀硫酸中 D.将钠放入足量稀盐酸中
6.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中…………………………………………………………… …….( )
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
7.自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是…………………………………………………… …….……….( )
A.AgNO3 B.FeCl2 C.Na2SO3 D.AlCl3
8.下列说法正确的是……………………………………………… …………………( )
A.漂白粉的有效成分是次氯酸钠
B.离子反应是向离子浓度减小的方向进行的
C.实验室盛装NaOH溶液的试剂瓶要用玻璃塞而不用橡皮塞
D.铁制品要防锈,而铝制品却不要防锈,这是由于铝的化学性质不如铁活泼
9.只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是 ( )
A.HCl B.BaCl2 C.AgNO3 D.NaOH
10.某同学在实验报告中有以下实验数据:①用托盘天平称取11.7 g食盐;②用量筒量取5.26 mL盐酸;③用广泛pH试纸测得溶液的pH值是3.5,其中数据合理的是 ( )
A.① B.②③ C.①③ D.②
11.为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中…………( )
A.通入氯气 B.加入Zn C.加入Fe D.加入Cu
12.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是…… …..( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
13.用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是… ..( )
A.④③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑥⑦ D.②⑥③⑦⑤⑥
14.碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为 ..( )
A.3.38g B.4.58g C.4.16g D.4.41g
15.把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中NO3-—的物质的量浓度是(单位:mol·L—1)…………………………………………………… …( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
16.下列叙述中,正确的是………………………………………… ………. ………( )
A.H2SO4的摩尔质量是98
B.等物质的量的O2和O3中所含的氧原子数相同
C.等质量的CO与CO2中所含碳原子数之比为11︰7
D.将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
17.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是……… …..( )
A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 = 2CuO; Cu + H2SO4(稀) = CuSO4 + H2O
C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O
18.下列叙述中,正确的是……………………………………………..…… … ..( )
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
19.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是… … …( )
① 氯水 ② 硫酸 ③ 硝酸锌 ④ 氯化铜
A.① B. ②① C. ①③ D. ③④
20.把金属铁加入氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余,则 ( )
A.溶液中有Fe2+、Cu2+ B.溶液中有Fe3+、Fe2+
C.剩下的固体是Fe和Cu D.溶液中不含Fe3+、Al3+
21.设NA表示阿伏加德罗常数,下列叙述正确的是………………………..… …..( )
A.46g Na与足量水充分反应时电子转移数为NA
B.25℃、101.3kPa时,11.2L H2中含有的原子数为NA
C.4℃、101.3kPa时,54mL H2O中含有的分子数为3NA
D.2L 1mol/L Na2SO4溶液中离子总数为3NA
22.在无色强酸性溶液中,下列各组离子能够大量共存的是…………..…... …..( )
A.Cl -、Na+、NO3-、Ca2+ B.NH4+、HCO3-、Cl-、K+
 C.K+、Ba2+、Cl-、SO42- D.Cu2+、NH4+、I-、Cl-
C.K+、Ba2+、Cl-、SO42- D.Cu2+、NH4+、I-、Cl-
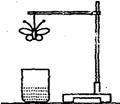
23.某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是…………..………………………….…..( )
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 稀硫酸 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
24.下列离子方程式的书写正确的是…………..…………………..………… .…..( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+
C.向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- = Al(OH)3↓
D.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O
 25.按右图装置持续通人气体x,并在管口P处点燃,实验
25.按右图装置持续通人气体x,并在管口P处点燃,实验
结果使澄清石灰水变浑浊,则X、Y可能是…( )
① H2和NaHCO3磺 ②CO和Na2CO3 ③CO和CuO
④H2和Fe2O3
A. ①② B. ①③ C. ②③ D. ③④
Ⅱ非选择题(共80分)
二、填空题(本题有4小题,共23分)
26.(9分)(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是 ,体积最小的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
(4)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸(H3PO4)溶液的体积比为 。
27.(4分).实验室制取Cl2的反应方程式为:MnO2 + 4HCl (浓) ![]() MnCl2 + Cl2↑+ 2H2O。从氧化还原反应的角度看,在制备H2、CO2、Cl2三种气体时,盐酸的作用分别是
__
、 _____ 、 _______
。
MnCl2 + Cl2↑+ 2H2O。从氧化还原反应的角度看,在制备H2、CO2、Cl2三种气体时,盐酸的作用分别是
__
、 _____ 、 _______
。
28.(3分)Cl2和SO2都有漂白作用,现将二者以等物质的量混合后再通入到品红溶液中,品红溶液将 (填褪色或不褪色),反应方程式为:
____ 。
29.(7分)(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。
(2)某次采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH值变小的主要原因是 __________
__________ 。
三、实验题(本题有3小题,共23分)
30.(10分)除去下列物质中所混有的少量杂质,指明应加入的试剂和使用的分离方法,写出有关的反应方程式。
(1)铜粉中混有少量铝粉 ;
 (2) FeCl3中混有少量FeCl2
;
(2) FeCl3中混有少量FeCl2
;
(3)Na2CO3中混有少量NaHCO3 。
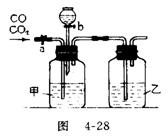
31.(5分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
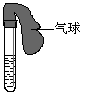 32.(8分)某学生课外活动小组利用右图所示装置分别做如下实验:
32.(8分)某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:___________________________________ ______。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是
。
四、推断题(本题有2小题,共20分)
33.(12分)已知A.B.C.D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
⑴ 则各是什么物质的化学式为:A 、B 、C 、D 。
⑵现象②中所发生的反应的化学方程式为:
、 。
⑶现象③中所发生反应的离子方程式为:
、 。
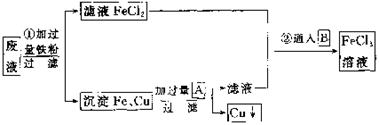 34.(8分)某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
34.(8分)某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)方框内物质A和B的化学式:A ,B 。
(2)根据图示第①步的有关离子方程式为 。
(3)第②步的化学方程式为 。
五、计算题(本题有2小题,共14分)
35.(8分)用适当溶液把3.31 g某铁矿石样品溶解,然后加过量碱溶液,生成沉淀,再灼烧沉淀,得2.40 g Fe2O3。已知该铁矿石中铁的氧化物的质量分数为70%。试计算:
⑴ 该铁矿石中铁的质量分数。
⑵ 该铁矿石中铁的氧化物的化学式。
36.(6分)向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,求原溶液中Fe3+的物质的量浓度。
高一化学上学期总复习检测题(一)
参考答案及评分标准
一、(本题共15小题,每小题3分,每小题只有一个正确选项)
1.C 2.A 3.D 4.B 5.B 6.B 7.D 8.B 9.D 10.A 11C
12.D 13.D 14.C 15.D 16.BC 17.B 18.D 19.C 20.C 21.C 22.A 23.B 24.D 25.B
二、填空题(本题有4小题)
26.(1) 9g 3.01×1023 9.03×1023 (2) CO2 NH3 CO2
(3) 125 2.5 (4) 6︰3︰2
27.氧化剂 酸性 一半盐酸做还原剂,一半盐酸起酸的作用
28.不褪色(1分) SO2 + Cl2 + 2H2O = 2HCl + H2SO4(2分)
29.(1)酸 5.6 雨水中溶解了CO2
(2)酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,发生的反应为:
2H2SO3 + O2 = 2H2SO4
三、实验题(本题有3小题)
30. (1) NaOH溶液,过滤,2Al + 2NaOH + 2H2O = 2NaAlO2+ 3H2↑(或用盐酸、稀硫酸)
(2) 通入Cl2, 2FeCl2 + Cl2 =2FeCl3
(3) 加热, 2NaHCO3![]() Na2CO3 + CO2↑+ H2O 31.(5分)
Na2CO3 + CO2↑+ H2O 31.(5分)
31.(1) NaOH溶液或碱溶液 浓H2SO4 浓H2SO4
(2) b a (3)(2分) a b
32 .(1) 稀氨水+酚酞的混合溶液 加热时氨气逸出,导致溶液的红色变浅;
(2) 溶有SO2的品红溶液 加热时SO2气体逸出,品红溶液恢复红色。
四、推断题(本题有2小题)
33. (1) (4分)A:BaCl2 B:FeSO4 C:AlCl3 D:NaOH;
(2) FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4,
4 Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(3) Al3+ + 3OH- = Al(OH)3↓,Al(OH)3 + OH- = AlO2- + 2H2O
34.(1) HCl Cl2
(2) 2Fe3+ + Fe = 3Fe2+,Cu2+ + Fe = Cu + Fe2+;
(3) 2FeCl2 + Cl2 = 2FeCl3
五、计算题(本题有2小题,共14分)
35.解:(1) 铁矿石中铁的质量分数为: ![]()
(2) 铁的氧化物中
n(Fe) : n(O)=![]()
故铁的氧化物的化学式为Fe3O4
36.解:因为:Fe3+ +3OH—=Fe(OH)3↓, Al3+ +3OH—=Al(OH)3↓,
Al(OH)3+3OH—=AlO2—+2H2O 根据物质的量比得:
|
b—a= n(Al3+)
解得:n(Fe3+)]=(4a/3-b)mol/L